"Lasciate che il vostro cibo sia la vostra medicina e la vostra medicina sia il cibo." (460 A.C, Ippocrate - 370 A.C). Olio di oliva extra vergine in quanto cibo e medicina.
L'olio d'oliva ricco di polifenoli. Alimento e medicina!
I polifenoli naturali dell'olio d'oliva sono delle molecole molto biodisponibili e altamente bioattive, il che conferisce loro molteplici benefici per la salute umana. Questi composti fanno parte della famiglia degli antiossidanti. Permettono di lottare contro i radicali liberi che hanno effetti deleteri: aggressioni delle cellule, modifica dell'DNA, ossidazione dei lipidi. Recenti studi hanno dimostrato che l'Idrossitirosolo dell'olio d'oliva migliora la funzione mitocondriale che previene l'invecchiamento del corpo. Il che ci porta a confermare che questo composto è un agente utile per prevenire l'invecchiamento e le malattie legate all'età. I polifenoli dell'olio d'oliva aiutano anche a proteggere dal cancro e al suo trattamento. In quest'ambito, è stato dimostrato che l'Idrossitirosolo e l'oleuropeina hanno un effetto anticancerogeno sul cancro del colon, il cancro del sangue, il cancro al seno... questi famosi composti agiscono contro il cancro mediante diversi meccanismi anti proliferativi e antiapoptotici. I benefici dei composti fenolici dell'olio d'oliva sul sistema cardiovascolare sono stati chiariti da diversi autori. In effetti, i polifenoli dell'olio d'oliva favoriscono la riduzione della presenza delle molecole di aderenza cellulare, aumentano la disponibilità del monossido di azoto, sopprimono l'aggregazione piastrinica, proteggono le LDL contro l'ossidazione per ritardare l'arteriosclerosi e riducono le reazioni infamatorie. Attualmente, altre virtù dei polifenoli dell'olio d'oliva sono riconosciute, includendo il loro effetto antibatterico, il trattamento e la prevenzione del diabete e della malattia di Alzheimer.
«L'ulivo, albero rustico e plurisecolare, è un simbolo di saggezza, di potenza, di pace e di salute»
(Pr Henri Joyeux)
Prefazione di Pr Henri Joyeux. L'Olio d'Oliva un tesoro per la nostra Salute
Ecco il libro che dimostra scientificamente e in modo comprensibile per tutti i benefici dell'Olio d'Oliva per la nostra SALUTE. E' importante capire la sua produzione, selezionare il migliore e consumarlo regolarmente essendo consci di tutti i benefici che porta al nostro corpo. Prevenire l'Alzheimer che fa così tanta paura, evitare l'invecchiamento prematuro dei nostri tessuti e organi, prevenire i cancri, le malattie cardiache da sovraccarico, gli eccessi di colesterolo, gli accidenti vascolari cerebrali... insomma rimanere in buona salute per il secolo nel quale ci troviamo, è il nostro desiderio più caro. L'Olio d'Oliva di questa zona rocciosa e rude dell'Atlas marocchino è un tesoro per la salute. Paragonato a tutti gli altri oli della fascia mediterranea e ben al-dilà, concentra dei polifenoli poco conosciuti: Tirosolo e Idrossitirosolo a tassi mai misurati in un alimento, 30 volte più (240 mg/kg) che negli oli generalmente consumati (8 mg/kg). Il suo tenore in polifenoli è massimo all'inizio della fase d’invaiatura, quando l'oliva prende il suo colore verde-rosso-violaceo nel tramonto dell'Atlas. Perché quest'olio di Oliva extra vergine «OLIVIE Plus 30x» è così ricco? La sofferenza ecologica dell'Ulivo, gli fa dare il meglio di sé per proteggersi e proteggerci: degli antiossidanti, antinvecchiamento, anti ateromatoso, antinfiammatori. Ai quali si aggiungono importanti concentrazioni di Acido Oleico, eccellente trasportatore del calcio vegetale dei nostri alimenti, olive, mandorle, noci, nocciole, prezzemolo e di tutta la frutta e verdura di stagione. Senza dimenticare la vitamina E, quella della fecondità, della giovinezza, che è una risorsa per “oliare i nostri neuroni” e rendere più innamorati spermatozoi e ovuli. Questo libro ha un grande valore scientifico. Mi congratulo calorosamente con i miei colleghi dell'Università di Fès che oltre alla loro esperienza, forniscono numerose prove scientifiche, le migliori della letteratura mondiale. Ho assaggiato quest'olio dorato, accompagna tutti i miei menù in famiglia e con gli amici, e la prescriverò senza ricetta nel mio mestiere di oncologo. «In effetti l'olio d'oliva ha degli effetti anticancerogeni specifici nelle donne malate di cancro al seno che vogliono evitare episodi recidivi, e molto probabilmente (anche se non è ancora stato scientificamente dimostrato) negli uomini malati di cancro prostatico o che vogliono evitarlo. Uno studio in vitro sulle linee cellulari di cancro al seno, ha dimostrato nel gennaio 2005 che l'acido oleico, il principale acido grasso monoinsaturo dell'olio d'oliva, tende a normalizzare la surrespressione di un gene del cancro, l'oncogene Her-2/neu, promotore di una forma grave (1 paziente su 5) del cancro al seno. Ricercatori di Chicago (Javier Menendez & coll in Annals of Oncology gennaio 2005) hanno dunque trovato un meccanismo molecolare che spiega gli effetti protettivi dell'olio d'oliva contro il cancro al seno nelle donne consumatrici. 1 Come bloccare l'Epidemia del cancro al seno e le recidive - Pr Henri Joyeux e Dr Bérengère Arnal - Ed. FX di Guibert 2010. Inoltre l'acido oleico stimola l'attività dell'Erceptine che è il trattamento di elezione che mira il gene Her-2/neu. L'acido oleico riduce di 46% l'oncogeno e l'Erceptine di 48%. insieme (acido oleico + Erceptine), osserviamo una sinergia di effetti con una riduzione del 70%. Questo è dunque l'effetto Herceptine like dell'acido oleico e dei polifenoli di oliva contro il cancro.» Tutti questi dati di scienza fondamentale concordano con i risultati degli studi epidemiologici che hanno dimostrato che le abitudini alimentari mediterranee hanno degli effetti significativi contro il cancro, le malattie cardiovascolari e anche per prevenire certi effetti dell'invecchiamento.
Pr Henri JOYEUX - Chirurgo Oncologo
Specialista internazionale della Prevenzione
con la Nutrizione delle malattie della civilizzazione
Facoltà di Medicina di Montpellier
Generalità sull'ulivo e l'olio d'oliva
- I. L'oliva, un frutto lautamente provvisto di nutrimenti salute
- 1. Origine
- 2. Storia
- 3. Caratteristiche dell'ulivo e del frutto, l'oliva
- 3.1 Stadi di maturazione
- II. Dal frutto oliva all'olio d'oliva
- 1. Principio dell'estrazione
- 1.1 Pulizia dei frutti
- 1.2 Frantumazione
- 1.3 Miscelazione
- 1.4 Separazione della fase liquida e solida
- III. Condizioni di stoccaggio dell'olio d'oliva
Composizione e proprietà chimiche dell'olio d'oliva
- I. L'olio d'oliva, fonte di antiossidanti e di acidi grassi buoni
- 1. Acidi grassi, triacilgliceroli, e gliceridi parziali
- 2. I polifenoli dell'olio di oliva, antiossidanti molto potenti
- 2.1 I monomeri fenolici
- 3. Tocoferoli
- 4. Idrocarburi
- 5. Pigmenti
- II. Analisi e quantificazione dei polifenoli dell'olio d'oliva
Effetti dell'olio d'oliva sulla salute
- I. I benefici dell'olio d'oliva sono essenzialmente attribuiti ai suoi polifenoli
- II. I polifenoli dell'olio d'oliva sono molto biodisponibili e bioattivi
- 1. Assorbimento dei composti fenolici
- 2. Metabolismo
- 3. Escrezione
- III. Potere antiossidante dei polifenoli dell'olio d'oliva
- 1. Sistemi antiossidanti enzimatici
- 2. Sistemi antiossidanti non enzimatici
- 3. I polifenoli dell'olio d'oliva, composti ad alto potere antiossidante
- IV. L'olio d'oliva ricco di polifenoli contro l'invecchiamento
- 1. Effetti positivi dell'Idrossitirosolo sulla biogenesi mitocondriale
- 2. Effetto antinvecchiamento dei polifenoli dell'olio d'oliva sulle cellule cardiache
- V. L'Idrossitirosolo e l'oleuropeina contro l'AIDS
- VI. L'Idrossitirosolo e i polifenoli dell'olio d'oliva, potenti anticancerogeni
- 1. Generalità
- 2. Idrossitirosolo/Oleuropeina, polifenoli ad alto impatto anticancerogeno
- 3. Effetto efficace dell'Idrossitirosolo/Oleuropeina sul trattamento e la prevenzione del cancro al seno
- VII. Effetto protettore dei polifenoli dell'olio d'oliva sul sistema cardiovascolare
- 1. Generalità
- 2. Composti fenolici e prevenzione dell'aterosclerosi
- 3. Effetti dei polifenoli dell'olio d'oliva contro l'aggregazione piastrinica
- 4. Effetto antinfiammatorio dei polifenoli dell'olio d'oliva
- 5. L'Idrossitirosolo dell'olio d'oliva aumenta il tasso del monossido di azoto, gas vasodilatatore
- VIII. La protezione dei polifenoli contro le lesioni delle proteine
- IX. Effetti antimicrobici dei polifenoli dell'olio d'oliva
- X. Prevenzione dei polifenoli dell'olio d'oliva contro il diabete
- XI. Prevenzione dei polifenoli contro la malattia di Alzheimer
Olio d'oliva. Naturalmente ricco di polifenoli
Le analisi dell'olio d'oliva extra vergine «OLIVIE Plus 30x» prodotto dalla compagnia ATLAS OLIVE OILS, hanno dimostrato che si tratta di un olio naturalmente ricco di polifenoli e in particolare in Idrossitirosolo a una concentrazione di 233 mg/kg, e in tirosolo a una concentrazione di 161 mg/kg (fig. 1); circa 30 volte più ricco di un olio extra vergine. La tabella 1 mostra i tenori in Idrossitirosolo e in tirosolo di 22 campioni di olio extra vergine convenzionale di quattro paesi mediterranei produttori di olio d'oliva Hrneirik et Frische (2004). In allegato, il certificato di analisi dell'olio rilasciato da un laboratorio italiano di grande reputazione. I risultati della figura 1 mostrano chiaramente che OLIVIE Plus 30x è l'olio d'oliva extra vergine più sano al mondo. È eccezionalmente ricco di polifenoli (Idrossitirosolo e Tirosolo), inoltre, è dotato di una forte attività antiossidante. Queste caratteristiche eccezionali e uniche dell'olio d'oliva OLIVIE Plus 30x provengono da ulivi piantati in un deserto roccioso (fig. 2 e 3). Come la vigna, è risaputo che l'ulivo ha bisogno di soffrire per produrre il meglio di sé. Visto l'ambiente molto caldo (fino a 50°C d'estate), il terreno sassoso dove le radici non possono svilupparsi facilmente, la scarsità d'acqua, gli ulivi si stressano. Si produce un fenomeno di panico negli ulivi (istinto di sopravivenza) che si traduce con una produzione elevata di polifenoli (antiossidanti), in particolare di Idrossitirosolo e Tirosolo (autodifesa).

Figura 1. Analisi di laboratorio dell'olio d'oliva naturalmente ricco di polifenoli OLIVIE Plus 30x.
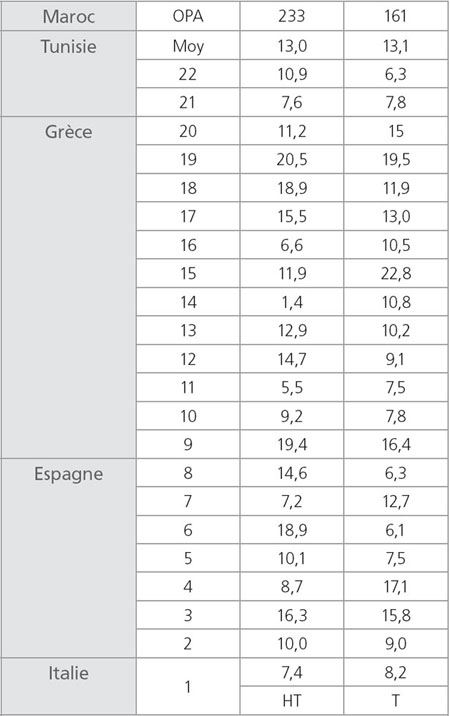
Tabella 1. Paragone del tasso (mg/kg) dell'Idrossitirosolo (HT) e del tirosolo (T) tra 22 campioni d'olio d'oliva dei 4 paesi mediterranei e quello del nostro olio «OLIVIE Plus 30x».


Figura 2. Deserto roccioso, Marocco.


Figura 3. Oliveto nel mezzo del Deserto roccioso in Marocco.
Generalità sull'ulivo e l'olio d'oliva
I. L'oliva, un frutto lautamente provvisto di nutrimenti salute
1. Origine
L'ulivo, albero caratteristico del bacino mediterraneo, è stato dalla notte dei tempi considerato come simbolo di saggezza, di pace, di ricchezza e di gloria. Quest'albero perfettamente adattato al clima temperato, ai terreni sassosi e calcari, non necessita l'apporto di fertilizzanti. Può essere originario della Siria, dell'Asia minore, dell'Etiopia, dell'Egitto, dell'India, di Creta, del Peloponneso, delle regioni costiere della Grecia , le isole dell'Egeo orientale (Lesbo, Samos e Thasos), e le isole Ionie possiedono tutti uliveti. Inoltre, l'ulivo è largamente diffuso a Cipro, sulle coste della Turchia, Libano, Palestina, il sud della Spagna, la Francia e l'Italia. In Nord Africa, la cultura dell'ulivo esisteva già prima dell'arrivo dei romani. Se è appannaggio dei paesi mediterranei, l'ulivo è anche coltivato, ai giorni nostri, in Algeria del sud, Australia, Giappone, in certe regioni della Cina (Ryan e Robards, 1998) e in Argentina (COI, 2010).
2. Storia
La coltivazione degli ulivi, così come la produzione e l'utilizzazione dell'olio d'oliva sono state delle pratiche ben conosciute e stabilite nella regione mediterranea più di 7000 anni fa. (Tsagaraki e al., 2004). La storia non ci informa sull'esistenza dell'utilizzo dei prodotti dell'ulivo dagli abitanti del mar Egeo. Ciò nonostante, sembra possibile che al meno dal periodo neolitico, ossia dal 8000 A.C., il frutto oleastro sia stato raccolto con altri frutti selvatici commestibili per completare l'alimentazione quotidiana. La palinologia, una scienza relativamente nuova che studia i granelli di polline, ha rivelato la presenza di polline d'oleastro verso la fine del neolitico, 3200-3100 A.C circa, in Kopais, Tessaglia e in Creta. I principi della coltivazione dell'ulivo sono stati apparentemente scoperti e formulati più tardi, a un certo punto del terzo millennio A.C, all'inizio dell'età del bronzo. I Cretesi erano in contatto con le civilizzazioni del Mediterraneo orientale e del Nord Africa, dove l'ulivo era già stato addomesticato. Questo contatto ha portato alla diffusione della conoscenza dell'oleicoltura in Creta. Gli archeologi suggeriscono che le prime coltivazioni di ulivi si sono espanse durante l'età del Bronzo. Durante questo periodo, la gestione delle popolazioni di olive, la potatura intenzionale e selettiva sono state probabilmente realizzate dall'uomo per ringiovanire l'ulivo, al fine di favorire la produzione di fiori e frutti.
3. Caratteristiche dell'ulivo e del frutto, l'oliva
L'ulivo è un albero tipicamente mediterraneo, da 6 a 8 metri d'altezza, con il tronco nodoso e la corteccia grigiastra e crepata. Le foglie sono bianche argentate sulla superficie inferiore, verdi grigiastre sulla parte superiore, opposte, persistenti, coriacee e lanceolate. I fiori, piccoli e bianchi, con quattro petali, sono riuniti a grappoli rizzati. L'ulivo è il nome comune di circa 35 specie di arbusti e alberi del genere Olea. Il nome è particolarmente utilizzato per la specie Olea europaea. L'origine botanica di quest'albero e l'inizio della sua coltivazione sono stati soggetto di litigio (Anon, 1983 ; Loukas et Krimbas, 1983 ; Blazquez, 1996). Delle 35 specie conosciute del genere Olea, O. Chrysophylla, trovata in Asia e in Africa è considerato come l'avo dell'ulivo. Ciò nonostante, un'altra teoria esiste secondo la quale l'avo sarebbe l'ulivo mediterraneo selvatico, Olea oleastro (Loukas e Krimbas, 1983). Altri considerano Olea oleastro come intermediario nello sviluppo dell'ulivo selvatico Olea chrysophylla a Olea europaea (Blazquez, 1996 ; Lavee, 1996).
| Regno | Plantae |
| Phylum | Magnoliophyta |
| Sotto Phylum | Magnoliophytina |
| Classe | Magnoliopsida |
| Sotto-classe | Dialypetales |
| Ordine | Lamiales |
| Famiglia | Oleaceae |
| Genere | Olea |
| Specie | Oleaeuropea L. |
| Sotto-Specie Famiglia | O.europeasubsp.europaeavar. sylvestris O.europeasubsp.europaeavar. Europaea |
Tabella 2. Situazione botanica della specie Olea europea L.
L'oliva è una drupa di forma ovale costituita da un pericarpo e di un endocarpo. Pesa da 2 a 12 g, anche se certe varietà possono pesare fino a 20 g. Il pericarpo comprende due parti: l'epicarpo (la pelle) e il mesocarpo (la polpa) che rappresentano circa il 65-83 % del peso totale. L'endocarpo (nocciolo) rappresenta dal 13 % al 30 % del peso totale. L'epicarpo è coperto di cera e passa dal verde chiaro al nero quando il frutto matura. La composizione chimica media dell'oliva è la seguente (fig. 4) : acqua 50 % ; oli 22 % ; polifenoli 1,5 % ; proteine 1,5 % ; zuccheri 18 % ; cellulosa 5,5 % ; minerali (ceneri) 1,5 %. altri componenti importanti sono le pectine, gli acidi organici, i pigmenti e i glicosidi di fenoli.
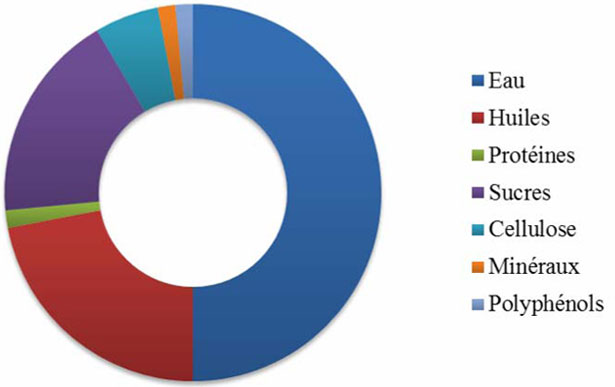
Figura 4. Composizione chimica del frutto, l'oliva.
3.1 Stadi di maturazione
L'aumento del peso del frutto è considerevole nel corso delle differenti fasi fino ad ottobre o metà novembre. Poi, il peso del frutto comincia a diminuire, essenzialmente per causa della perdita di umidità. Di conseguenza, un aumento del tenore in olio è osservato, generalmente dal mese di ottobre fino al mese di dicembre. L'accumulo di olio comincia da fine luglio a inizio agosto. Durante l'autunno e l'inverno, il frutto diventa nero e il tenore in olio raggiunge il suo massimo livello. L'olio è principalmente concentrato nel pericarpo (96-98 %). La prima tappa di maturazione (fig. 5), fine maggio/giugno/agosto, è conosciuta con il nome di stadio «Verde» durante il quale la grandezza del frutto aumenta considerevolmente. Poi, il colore dei frutti vira al rosso-violaceo, poi al nero. È lo stadio dell'invaiatura che avviene a metà ottobre. Il tenore in polifenoli dell'oliva è al suo massimo all'inizio della fase di invaiatura quando l'oliva presenta un colore verde-rosso-violaceo.
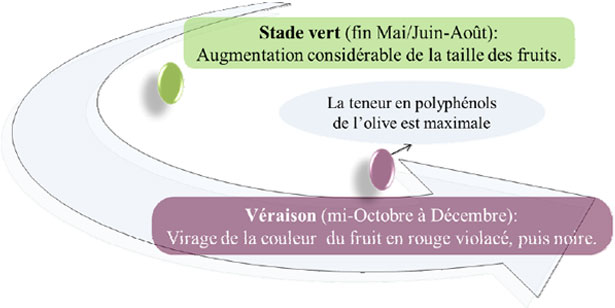
Figura 5. Stadi di maturazione dell'oliva.
La maturazione dell'oliva è un lento e lungo processo che dura diversi mesi e varia a seconda della latitudine, della varietà, della disponibilità in acqua, della temperatura e della pratiche culturali. Di conseguenza, il grado di maturità è un fattore di qualità importante. Da un punto di vista scientifico, è difficile misurare e esprimere in termini matematici il contributo di ogni fattore alla qualità globale dell'olio estratto. Secondo Montedoro e i suoi colleghi (1986), lo stadio di maturità contribuisce nel 30 % alla qualità dell'olio. Altri fattori contribuiscono nelle percentuali seguenti: sistema d'estrazione (30 %); trasporto e condizioni di stoccaggio (15 %); raccolto (5 %); vari (20 %).
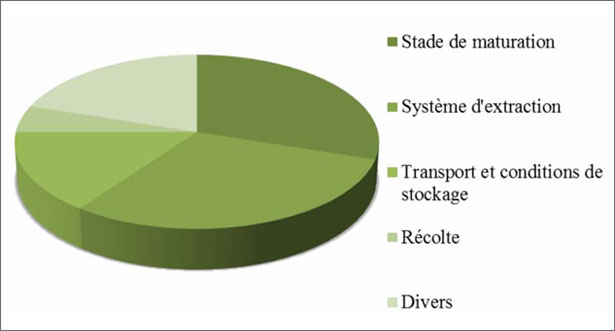
Figura. 6 Diversi fattori che influenzano la qualità dell'olio d'oliva.
Diversi metodi sono stati proposti per determinare lo stadio di maturità delle olive. Tra queste, si cita la determinazione del rapporto d'assorbanza della pasta di olive in spettrofotometria nella zona visibile a due diverse lunghezze d'onda (665 nm e 525 nm). Il Consiglio Oleicolo Internazionale (Le Conseil Oléicole International - 1984) ha proposto una tecnica semplice basata sulla valutazione del colore di 100 olive estratte, a caso, in un campione di 1 kg. Per calcolare l'indice di maturazione, è utilizzata la formula seguente:
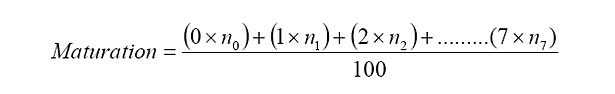
Dove n0, n1, n2, ... ... n7, sono i numeri di olive appartenente a ciascuna delle otto categorie seguenti:
0 = Olive la cui pelle è di un colore profondo o verde scuro.
1 = Olive la cui pelle è di colore giallo o giallo-verde.
2 = Olive la cui pelle è di colore giallastro con delle macchie rossastre.
3 = Olive la cui pelle è rossastra o di colore viola chiaro.
4 = Olive la cui pelle è nera e la polpa è ancora completamente verde.
5 = Olive la cui pelle è nera e la polpa è mezza violetta.
6 = Olive la cui pelle è nera e la polpa è viola quasi tutto il lungo.
7 = Olive la cui pelle è nera e la polpa è completamente nera.

Figura 7. Gli indici di maturazione del frutto d'oliva.
Secondo quest'approccio, il miglior periodo di raccolto dell'olive corrisponde al valore dell'indice di maturazione 5. Quest'indice ha un valore relativo e il suo utilizzo non può essere generalizzato visto che il suo valore può essere influenzato da diversi fattori quali la varietà dell'oliva, la zona di coltivazione e le condizioni climatiche. Così, l'indice di maturazione può essere calcolato nei diversi paesi produttori, associando il valore di maturazione delle olive provenendo da certe zone alla qualità dell'olio che vi è prodotto e ai tassi di composti fenolici. In regola generale, il tenore massimo in polifenoli dei frutti d'oliva è raggiunto all'inizio della fase di invaiatura. Di conseguenza, la decisione di produrre olive più dolci con un tenore più alto in olio o un olio più piccante, dipende fortemente dal periodo del raccolto, che è il fattore che più influisce sulla composizione e sulla qualità sensoriale.
II. Dal frutto all'olio d'oliva
L'olio d'oliva, puro succo di frutta, è sano e consigliato dai nutrizionisti. E' importante sapere come'è prodotto per fare meglio la vostra scelta!
L'olio d'oliva è ottenuto per frantumazione dei pericarpi dei frutti e non dei loro semi, in un mulino a olio specifico. Il tenore in olio varia a seconda del territorio, della varietà, dello stadio di maturità al raccolto e delle pratiche agronomiche locali. Durante questi ultimi anni, questo processo generale di frantumazione delle olive ha conosciuto degli sviluppi tecnologici che tendono alla meccanizzazione completa del processo, l'aumento della capacità di lavoro e la specializzazione del processo di estrazione nell'ottica di ridurre i costi, ma anche di migliorare la qualità dell'olio (Ben Sassi e al., 2006).
1. Principio dell'estrazione
L'obiettivo ideale di ogni metodo di estrazione consiste nel produrre la più grande quantità di olio possibile senza alterazione della sua qualità originaria. Tuttavia, se la qualità non deve essere modificata, è necessario utilizzare unicamente dei metodi meccanici o fisici per estrarre l'olio, evitando le reazioni chimiche ed enzimatiche che potrebbero alterare la sua composizione naturale. Lo schema di estrazione recentemente messo in atto comprende quattro operazioni principali:
1. Pulizia dei frutti (defogliazione, lavaggio delle olive);
2. Preparazione della pasta (frantumazione, miscelazione);
3. Separazione della fase solida (sansa) e liquida (olio e acqua di vegetazione);
4. Separazione delle fasi liquide (olio/acqua di vegetazione).
1.1 Pulizia dei frutti
La pulizia comporta due operazioni: la mondatura dalle foglie e il lavaggio. I defogliatori aspirano le foglie, i rametti e le impurità attraverso un flusso d'aria potente generato da un ventilatore d'estrazione. Dopo di che, le olive sono lavate da una corrente d'acqua.
1.2 Frantumazione
Questa operazione è destinata a frantumare le cellule dell'oliva e a liberare le goccioline di olio contenute nel vacuolo. Da un punto di vista pratico, è impossibile frantumare tutte le cellule, di conseguenza, estrarre tutto l'olio che contengono. D'altra parte, le goccioline sono rivestite da una pseudo-membrana anfoterica che tende a mantenere l'olio in uno stato di emulsione, la cui stabilità dipende della grandezza delle goccioline: più sono piccole, più sono stabili. Inoltre, una piccola quantità di olio resta intrappolata nel sistema colloidale formato dalle pectine nella pasta.
1.3 Miscelazione
L'olio deve essere estratto con mezzi meccanici e deve essere liberato a partire dai tessuti in modo tale che le goccioline possono unirsi in gocce più grosse fino a formare quelle che si chiamano le “tasche”. La miscelazione è fondamentale per aumentare il rendimento dell'estrazione. È concepito per rinforzare l'effetto di schiacciamento e uniformizzare la pasta. Il suo primo obiettivo è di rompere l'emulsione olio/acqua in modo che le goccioline di olio si assemblino per formare delle gocce più grosse. Di Giovacchino (1989, 1996) ha studiato la percentuale di grandezza delle gocce d'olio nella pasta frantumata. Dopo frantumazione, solo il 45 % delle gocce hanno presentato un diametro di più di 30 micron, che è la grandezza minima per la separazione dell'olio in sistema continuo, mentre questa percentuale si eleva al 80 % dopo la miscelazione, con un aumento concomitante del numero di gocce di grande diametro (fig. 8a e 8b).
Figura 8a. Percentuale delle grandezze delle gocce d'olio nella pasta, dopo la frantumazione (a). (Di Giovacchino e al., 2002).
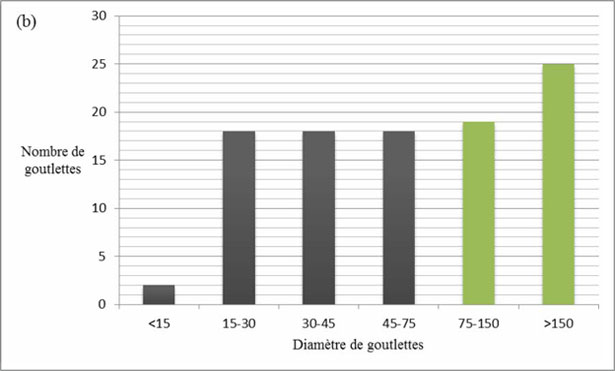
Figura 8b. Percentuale delle grandezze delle gocce d'olio nella pasta , dopo miscelazione (b) (Di Giovacchino e al., 2002).
1.4 Separazione della fase liquida e solida
La frantumazione e la miscelazione portano alla formazione di una pasta che contiene della materia solida e dei fluidi. La materia solida chiamata sansa è costituita da resti di nocciolo, di epidermide, di pareti cellulari, ecc., mentre la parte fluida è composta da olio e di acqua di vegetazione. La separazione della sansa dalla miscela olio/acqua di vegetazione richiede sistemi di pressione, di centrifuga e di percolazione (Caputo e al., 2003). Nel corso di queste tappe, sono utilizzati diversi apparecchi funzionanti secondo i principi delle forze fisiche.
Sistema a pressa
Sono dei sistemi classici a pressione con l'aiuto di frantumatori. La frantumazione delle olive, seguita dalla miscelazione ,si fa sotto delle mole. Una pasta è ottenuta nel giro di mezz'ora circa. È composta da sansa e da un mosto contenente l'olio e l'acqua di vegetazione. La separazione delle due fasi solida-liquida si ottiene per semplice pressione, mentre l'olio è separato dall'acqua per decantazione naturale.
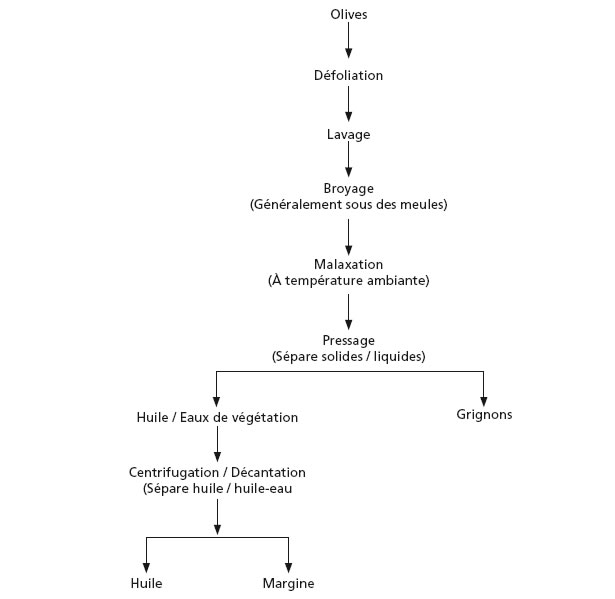
Figura 9. Estrazione dell'olio d'oliva con il sistema di pressa tradizionale.
Oggi, l'estrazione per pressione (fig. 9) è effettuata in super-presse idrauliche con una pressione che va fino a 400 atm. Il sistema super-pressa funziona (32) in modo semplice con un aumento progressivo della pressione fino al suo valore massimo ottenuto dopo 45- 60 min e che è mantenuta per 10-20 min. Dopo la pressatura, una piccola quantità di acqua è utilizzata per sciacquare il materiale e trasferire l'olio verso i bacini di chiarificazione. In media, il rendimento di trasformazione ottenuto si eleva al 86-90 % e l'umidità della sansa a 28% circa.
Centrifugazione
Questo metodo si basa sulla separazione dei differenti componenti di una miscela in funzione della loro densità. Se la sola forza gravitazionale viene applicata, la velocità di separazione può essere estremamente lenta, tuttavia, se la miscela è sottoposta a una forza di gravitazione artificiale, la velocità di separazione può essere aumentata. Questo viene fatto con delle macchine girevoli la cui velocità e l'efficacia di separazione sono direttamente proporzionali alla velocità angolare al raggio di rotazione, così come della differenza di densità dei liquidi che devono essere separati. Le macchine utilizzate sono delle centrifughe orizzontali che operano a una velocità angolare fino a 3000 volte più grandi dell'accelerazione gravitazionale naturale. La centrifugazione in continuo (fig. 10) comprende le tappe seguenti: mondatura e lavaggio, frantumazione delle olive, miscelazione della pasta di olive, centrifugazione con o senza addizione d'acqua per il sistema a due e a tre fasi, rispettivamente.
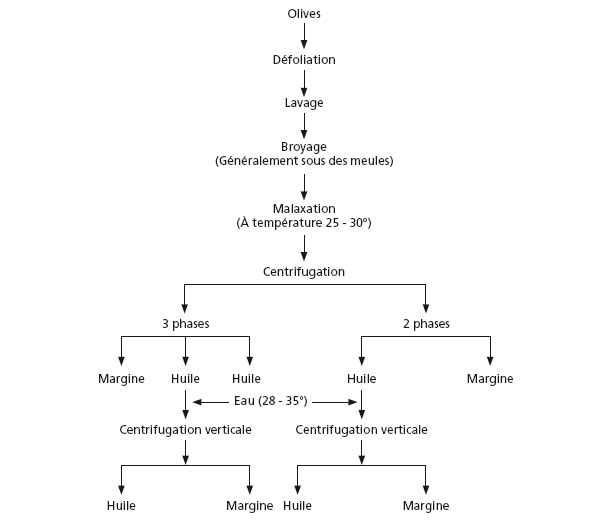
Figura 10. Estrazione dell'olio d'oliva con il sistema di centrifugazione.
III. Condizioni di stoccaggio dell'olio d'oliva
L'olio d'oliva può essere stoccato per diversi mesi. Durante lo stoccaggio, l'olio d'oliva può subire dei cambiamenti organoleptici caratterizzati dall'aumento dell'acidità (dovuta all'azione dei lipasi) e lo sviluppo delle reazioni d'irrancidimento. Per questo, un insieme di precauzioni devono essere messe in atto per lo stoccaggio dell'olio d'oliva:
- serbatoi o tamburi per lo stoccaggio dovrebbero essere costruiti in materiale inerte e impermeabile all'olio.
- l'olio deve essere a riparo dell'aria, della luce, e degli sbalzi di temperatura.
- l'olio deve essere conservato all'interno della camera di stoccaggio. Se lo stoccaggio ha luogo in esterno, i serbatoi devono essere rivestiti esternamente per evitare bruschi cambi di temperatura.
- l'olio deve essere stoccato a una temperatura compresa tra 12 e 18 °C, evitando il riscaldamento e il gelo. Altrimenti l'olio diventa biancastro, relativamente solido, con un deposito formato dalla cristallizzazione parziale dei trigliceridi e degli acidi grassi saturi durante l'inverno (a una temperatura inferiore a 10°C).
Le temperature superiori a 22-25°C devono ugualmente essere evitate perché accelerano le modificazioni biochimiche e i fenomeni di ossidazione che possono condurre all'irrancidimento dell'olio d'oliva (Sacchi, 2007).
Composizione e proprietà chimiche dell'olio d'oliva
I. L'olio d'oliva, fonte di antiossidanti e di acidi grassi buoni
La composizione chimica dell'olio d'oliva contiene elementi maggiori e minori (fig. 11). L'olio d'oliva possiede una composizione nutrizionale equilibrata in acidi grassi e trigliceridi (98 % del peso totale). L'abbondanza dell'acido oleico, un acido grasso monoinsaturo, è la caratteristica che definisce l'olio d'oliva rispetto agli altri oli vegetali. L'acido oleico (C18 :1 n-9) rappresenta dal 56 al 84% degli acidi grassi dell'olio d'oliva (Rossell, 2001), mentre l'acido linoleico (C18 :2 n-6) che è un acido grasso polinsaturo essenziale per l'alimentazione umana, rappresenta dal 3 al 21% (Tiscornia e al., 1982; Visioli e al., 1998). I composti minori, rappresentano circa il 2 % del peso totale dell'olio, in particolare, più di 230 composti chimici, quali gli alcoli alifatici e triterpenici, gli steroli, gli idrocarburi, i composti volatili e i polifenoli (Servili e al., 2002). Tuttavia, è la presenza di composti fenolici e altri antiossidanti particolari che conferiscono all'olio d'oliva un'alta stabilità contro l'ossidazione con un colore e un sapore unici, distinguendolo dagli altri oli. I principali antiossidanti dell'olio d'oliva sono i caroteni e i composti fenolici, compresi i fenoli lipofili e idrofili (Boskou, 1996). I tocoferoli (fenoli lipofili) possono essere trovati in oli di altri vegetali, mentre certi fenoli idrofili come l'Idrossitirosolo dell'olio d'oliva sono generalmente assenti negli altri oli e grassi (Boskou, 1996 ; Shahidi, 1997).
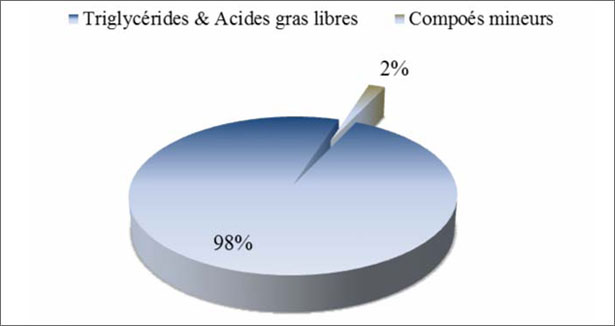
Figura 11. Composizione chimica dell'olio d'oliva.
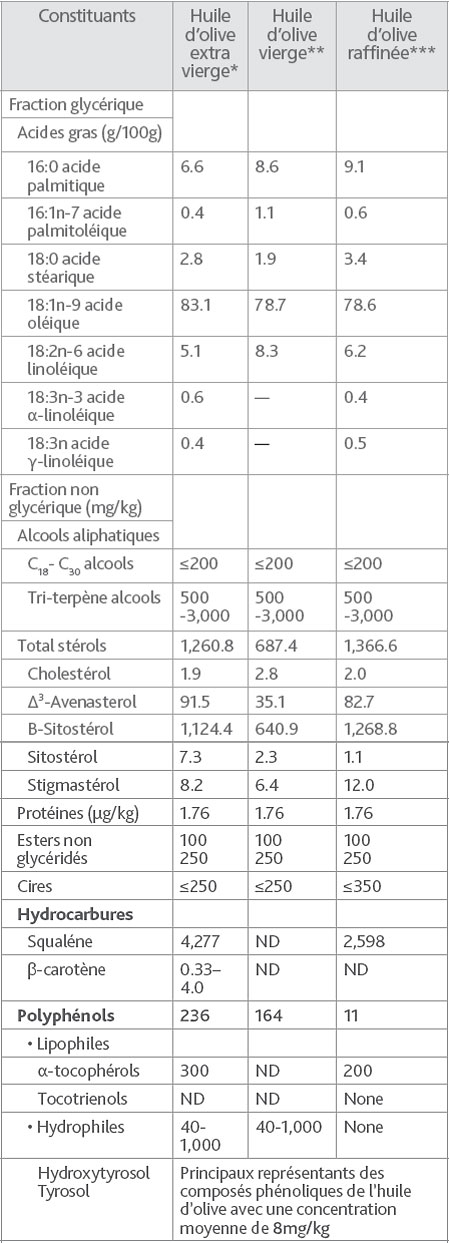
Tabella 3. Principali costituenti dell'olio d'oliva (Huang e al., 2008).
*L'olio d'oliva extra vergine è l'olio ottenuto dal frutto dell'ulivo unicamente mediante processi meccanici o altri processi fisici in condizioni termiche particolari, che non portano alterazioni dell'olio e non hanno subito nessun trattamento oltre al lavaggio in acqua, la decantazione, la centrifugazione e il filtraggio. L'acidità libera espressa in acido oleico è al massimo di 1 grammo per 100 grammi.
**L'olio d'oliva vergine è l'olio ottenuto dal frutto dell'ulivo unicamente mediante processi e trattamenti identici all'olio d'oliva extra vergine, ma la sua acidità libera espressa in acido oleico è al massimo di 2 grammi per 100 grammi.
***L'olio d'oliva raffinato è l'olio d'oliva ottenuto dall'oliva vergine mediante delle tecniche di raffinazione che non portano a modificazioni della struttura gliceridica iniziale.
1. Acidi grassi, triacilgliceroli e gliceridi parziali
Gli acidi grassi presenti nell'olio d'oliva sono: l'acido palmitico (C16 : 0), l'acido palmitoleico (C16 : 1), l'acido stearico (C18 : 0), l'acido oleico (C18 : 1), l'acido linoleico (C18 : 2), l'acido linolenico (C18 : 3), l'acido miristico (C14 : 0). Gli acidi eptadecanoici e eicosanoici si trovano in quantità minime. Scano e al., (1999), hanno trovato trace di acidi 11-cis-vaccenici e eicosenoici analizzando una frazione dell'olio d'oliva dal RMN-13C (Risonanza Magnetica Nucleare).
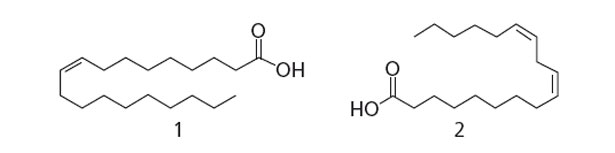
Figura 12. Struttura degli acidi grassi maggiori dell'olio d'oliva, (1) acido oleico, (2) acido linoleico (Amanda e al., 2010).
Il tenore in acidi grassi dell'olio d'oliva varia in funzione della zona di produzione, della latitudine, del clima, della varietà e dallo stadio di maturità del frutto. Baccouri e al. (2008) hanno provato che il ratio acido oleico/acido linoleico mostra una tendenza ad abbassarsi con la maturità delle olive. Inoltre, gli oli greci, italiani e spagnoli sono povere di acidi linoleici e palmitici. In più, presentano una percentuale elevata in acido oleico. Gli oli marocchini e tunisini sono ricchi di acidi linoleici e palmitici e più poveri di acido oleico. Sulla base delle analisi dei campioni provenienti da diversi paesi, gli oli d'oliva possono essere classificati in due tipi:
- olio con basso tenore in acidi linoleici e palmitici e ricchi di acido oleico,
- olio con un alto tenore in acidi linoleici e palmitici e con basso tenore in acido oleico.
La composizione in acidi grassi dell'olio d'oliva dipende della maturità dell'oliva frantumata. Ninni (1999), ha segnalato che l'acido oleico si forma prima nel frutto e che esiste un forte legame antagonista tra gli acidi oleici, palmitici, palmitoleici e l'acido linoleico.
2. I polifenoli dell'olio d'oliva, antiossidanti molto potenti
Il termine "polifenoli" è attribuito alla frazione fenolica polare dell'olio d'oliva (un termine desueto nelle recenti pubblicazioni). Questo termine è utilizzato nella letteratura per definire le sostanze che possiedono un nucleo benzenico portando uno o più gruppi idrossili, compresi i loro derivati funzionali (Harborne, 1989). I composti fenolici presenti nell'olio d'oliva, estraibili dalla miscela acqua/metanolo, sono comunemente designati come biofenoli (Uccella, 2001). I lavori che s'interessano a questi composti sono aumentati in modo esponenziale nel corso dei ultimi 10 anni, per varie ragioni: i composti fenolici sono legati alla stabilità dell'olio, in particolare, per le loro proprietà biologiche. Attualmente, diversi composti fenolici contenuti nell'olio d'oliva, principalmente l'Idrossitirosolo e i suoi derivati, sono soggetti di ricerche approfondite allo scopo di stabilire una relazione tra gli apporti alimentari e il rischio di diverse malattie quali il cancro e le malattie cardiovascolari. La frazione fenolica dell'olio d'oliva è costituita da una miscela eterogenea di composti. Ognuno di questi incide sulle proprietà chimiche e ha un'influenza particolare sulla qualità dell'olio (Psomadiou e al., 2003). La presenza di fenoli idrofili nell'olio è stata evidenziata più di 40 anni fa da Cantarelli e Montedoro (1961;1969).
2.1 I monomeri fenolici
I monomeri fenolici dell'olio d'oliva, che raggruppano gli acidi e gli alcoli fenolici sono (in ordine alfabetico) : 4-acetossi-etile-1, 2-di-idrossibenzene, 1-acetossipinoresinolo, apigenina, l'acido caffeico, l'acido cinnamico (non un fenolo), acidi o – e p-cumarico, acido ferulico, l'acido gallico, l'acido omovanillico, acido p-idrossibenzoico, Idrossitirosolo, luteolina, l'oleuropeina, pinoresinolo, acido protocatechico, l'acido sinapico, l'acido siringico, tirosolo, l'acido vanillico e la vanillina. La presenza d'acido elenolico (non un fenolo) nella stessa frazione è stata ugualmente verificata a più riprese (Brenes e al., 2000, Morales e Tsimidou, 2000; Owen e al., 2000; García e al., 2001; Mateos e al., 2001; Boskou, 2002). Il tirosolo, l'Idrossitirosolo e i loro derivati sono i principali rappresentanti della frazione monomerica. La parte la più polare dell'estratto metanolo/acqua contiene i fenoli liberi e gli acidi fenolici. La parte la meno polare contiene l'oleuropeina agliconi (l'Idrossitirosolo esterificato all'acido elenolico) e il ligstroside (tirosolo esterificato all'acido elenolico), la luteolina e l'apigenina (flavoni), e anche l'acido cinnamico e l'acido elenolico. Bianco e i suoi collaboratori (2001) hanno trovato una nuova classe di fenoli: idrossile-iso-cromano. L'identificazione dei due composti di questa classe, 1-fenil-6, 7-diidrossi-isocromano e 1 - (3-metossi-4-idrossi) fenil-6, 7-diidrossi-isocromano è stata confermata paragonando i spettri dei polifenoli, isolati dall'olio per estrazione in fase solida, con gli spettri LC-MS dei composti derivati da una reazione tra l'Idrossitirosolo e gli aldeidi aromatici (Benzaldeide e vanillina). Una tale reazione si produce ugualmente in natura e l'acido oleico gioca il ruolo di catalizzatore. L'Idrossitirosolo, presente nei frutti di oliva, è nella sua forma glicolizzata, ma principalmente legata sotto forma di estere alla frazione aglicone dell'oleuropeina. Durante la fase di miscelazione, l'Idrossitirosolo è liberato sotto l'azione dei glicosidasi e degli esterasi (fig. 13). Questo processo idrolitico, che migliora anche la quantità di composti carbonilati, favorisce la formazione di derivati isocromani.
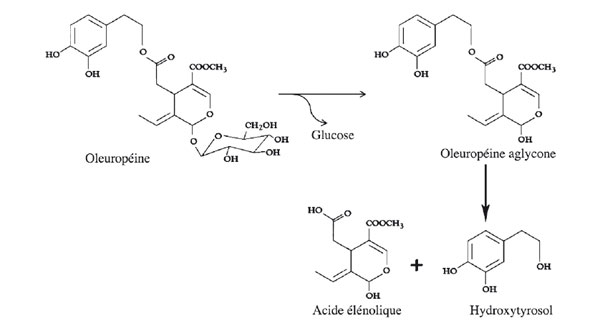
Figura 13. Origine dell'Idrossitirosolo (Granados-Principal e al., 2010)
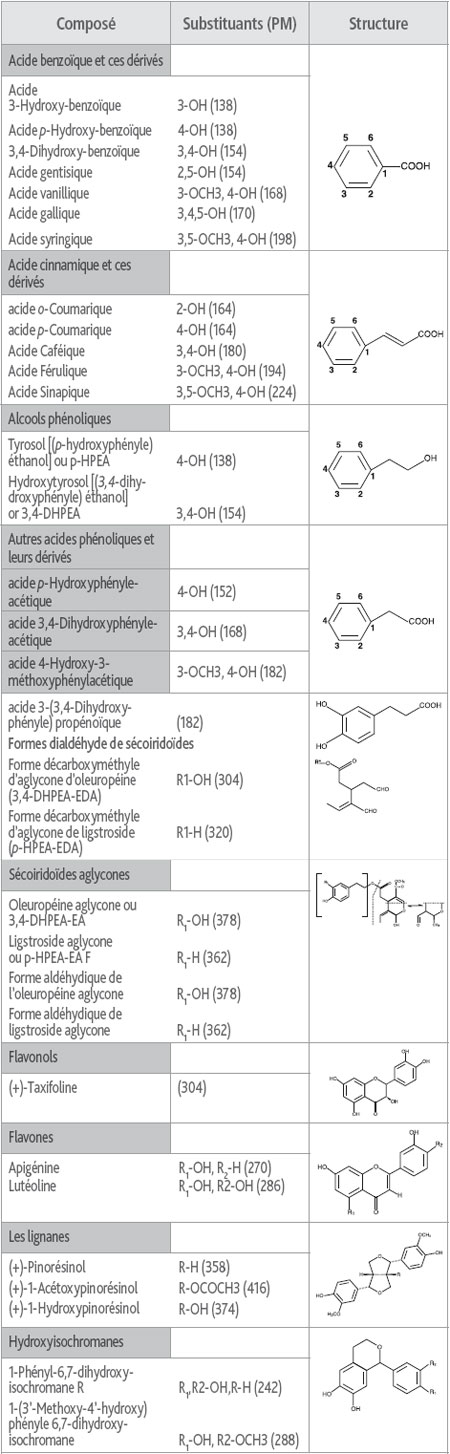
Tabella 4. I composti fenolici nell'olio di oliva vergine: nome di composti, la struttura chimica generale e il peso molecolare (PM#: g.mol-1), (Bendini e al., 2007).
L'oleocantal e altri composti fenolici sono stati identificati solo recentemente (fig. 14) (Bianco e al., 2005 ; Beauchamp e al., 2005). Rimane da verificare se questi composti sono presenti negli oli specifici (estratte da cultivar specifici) o se sono inerenti agli oli di oliva di buona qualità. Beauchamp e i suoi collaboratori (2005), affermano che l'oleocantal, un composto che ha la stessa attività farmacologica dell'ibuprofene®, medicinale antinfiammatorio, si trova unicamente nell'olio d'oliva extra vergine appena pressata e la sua presenza è legata alla sensazione pungente in gola.
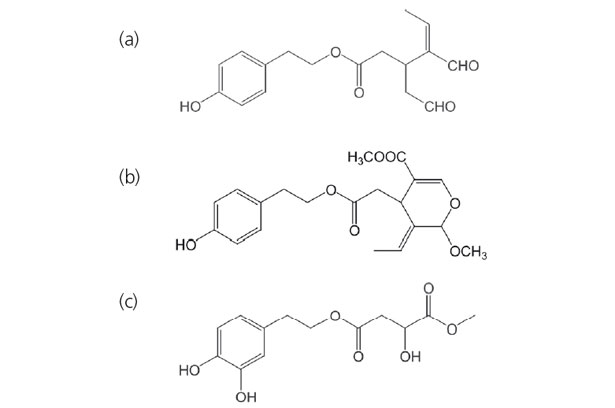
Figura 14. Composti fenolici recentemente identificati nell'olio d'oliva: (a) oleocantal, (b) acetal metilico dell'aglicone di ligstroside e (c) estere β-Idrossitirosolo di metil malate.
3. Tocoferoli
La ricerca sulla presenza e i tassi di tocoferoli negli oli d'oliva vergini ha dimostrato che tra gli otto “E-vitaminari” conosciuti, l'α-omologo comprende 90 % del tenore in tocoferolo totale. L'α-tocoferolo si trova sotto forma libera. I tassi registrati fanno apparire una larga gamma di milligrammi d'α-tocoferolo per kg d'olio, che dipende dai cultivar e dai fattori legati alle tecnologie utilizzate. L'introduzione di buone pratiche di fabbricazione e di programmi di controllo qualità per tutti i tipi di oli d'oliva commestibili ha avuto un impatto positivo sui tassi di tocoferolo. I tassi attuali sono molto più elevati del valore medio di 100 mg / kg nell'olio del passato (Gunstone e al., 1994; Belitz e al., 2004). I livelli di α-tocoferolo possono essere legati alla quantità elevata di pigmenti di clorofilla e alla sua attività concomitante contro i radicali ossigenati (Grammes e Eskins, 1972). La concentrazione in tocoferolo sembra essere ridotta nei frutti maturi. I dati sull'influenza del sistema di estrazione variano (Psomiadou e Tsimidou, 1998; Beltran e al., 2005). La raffinazione o l'idrogenazione comporta una perdita di tocoferoli (Andrikopoulos e al., 1989; Rabascall e Riera, 1987).
4. Idrocarburi
Due idrocarburi sono presenti in quantità importanti nell'olio d'oliva, lo squalene e il ß-carotene. Lo squalene (2,6,10,15,19,23 esametil-2-,6,10,14,18,22 tetracosaesano) è il metabolite precedente la formazione del nucleo degli steroli. La sua presenza è considerata come parzialmente responsabile degli effetti benefici dell'olio d'oliva sulla salute e della sua azione chemio-preventiva contro certi cancri (Rao e al., 1998, Smith e al., 1998). È il maggior componente della frazione insaponificabile dell'olio d'oliva e rappresenta più del 90 % degli idrocarburi (Perrin, 1992 ; Lanzón e al., 1994). La sua concentrazione varia da 200 a 7500 mg per kg d'olio (Perrin, 1992). Anche delle concentrazioni più elevate fino a 12000 mg/kg sono state segnalate (Lanzón et al., 1994). Questa quantità dipende del cultivar (De Leonardis e al., 1998 ; Manzi e al., 1998), del metodo di estrazione dell'olio (Nergiz e Ünal, 1990), inoltre, è considerevolmente ridotta nel corso del processo di raffinazione (Mariani e al., 1992; Lanzón e al., 1994). La variazione delle concentrazioni può essere parzialmente dovuta ai differenti metodi di analisi utilizzati (Nenadis et Tsimidou, 2002). La frazione d'idrocarburi d'olio d'oliva vergine contiene anche dei diterpeni e dei triterpeni, delle poliolefine isoprenoidale, e delle n-paraffine (Lanzon e al., 1994).
5. Pigmenti
Il colore dell'olio d'oliva è il risultato delle tinte verdi e gialli dovute alla presenza di clorofilla e di carotenoidi. È influenzato dal cultivar d'oliva, l'indice di maturazione, la zona di produzione, il sistema di estrazione e le condizioni di stoccaggio. Di conseguenza, il colore è considerato come un indice di qualità; purtroppo, dei metodi standardizzati per la sua misurazione non esistono oggi. Le clorofille perdono i loro ioni magnesio e si trasformano in feofitine che sono dei pigmenti verdi giallastri. Tra questi ultimi, la feofitine α (Phéo α) è predominante (Mínguez-Mosquera e al., 1990; Mínguez-Mosquera e al., 1991; Rahmani e Csallany, 1991; Gandul-Rojas e Mínguez-Mosquera, 1996; Psomiadou e Tsimidou, 2001).
II. Analisi e quantificazione dei polifenoli dell'olio d'oliva
Il tenore in polifenoli è significativamente legato alla qualità dell'olio d'oliva vergine e il loro contributo alla stabilità ossidativa dell'olio è ormai largamente accettata. Le condizioni agronomiche e tecnologiche della produzione dell'olio d'oliva aumentano fortemente la qualità e la quantità dei composti fenolici idrofili. Per queste ragioni, l'identificazione e la quantificazione di questi componenti sono di grande interesse. Sono state proposte numerose procedure di analisi orientate verso la determinazione del profilo completo fenolico. Il metodo colorimetrico universalmente applicato per la determinazione dei fenoli nell'estratto acqua/metanolo è basato sull'utilizzo del reattivo di Folin-Ciocalteu. I risultati sono generalmente espressi in equivalenze dell'acido caffeico (mg acido caffeico / kg d'olio), anche se altri fenoli possono essere ugualmente utilizzati come standard, ovvero: l'acido gallico e l'acido tannico (Tsimidou, 1999). I risultati possono variare, in funzione della norma utilizzata e della concentrazione relativa dei diversi composti (Singleton e al., 1999; Hrncirik e Fritsche, 2004). Tuttavia, il metodo colorimetrico classico è largamente applicato per la quantificazione dei fenoli totali polari, perché fornisce una buona indicazione sulla stabilità dell'olio (Gutfinger, 1981; Aparicio e al., 1999; Blekas e al., 2002; Psomiadou e al., 2003). In generale, la procedura di analisi per la determinazione dei diversi composti fenolici nell'olio d'oliva comporta tre tappe principali: l'estrazione a partire da l'olio, la separazione analitica e la quantificazione. L'insieme delle tecniche di estrazione a base di ELL (Estrazione Liquido-Liquido) o di EPS (Estrazione in Fase Solida) sono state utilizzate per isolare la frazione fenolica polare dell'olio d'oliva. Le tecniche di analisi si basano su dei metodi spettrofotometrici, quali la cromatografia in fase gassosa (GC), la cromatografia liquida ad alta performance (HPLC) e l'elettroforese capillare (CE). Tuttavia, la CE è stata recentemente applicata all'analisi dei composti fenolici dell'olio d'oliva, e così, ha aperto grandi orizzonti, sopratutto in ragione della sua alta risoluzione. La tecnica è stata ottimizzata dalla riduzione del volume del campione e della durata dell'analisi (Carrasco-Pancorbo e al., 2005).
Effetti dell'olio d'oliva sulla salute
I. I benefici dell'olio d'oliva sono essenzialmente attribuiti ai suoi polifenoli
L'olio d'oliva è ricco di antiossidanti, come i polifenoli, e in particolare, l'Idrossitirosolo e il tirosolo. Permettono di prevenire e di trattare le malattie cardiovascolari, i cancri, il diabete, le malattie neurodegenerative, l'infiammazione e l'invecchiamento. Sono antimicrobici e giocano un ruolo importante nel rafforzamento del sistema immunitario e la protezione di certi tessuti e organi contro i danni ossidativi: cervello, fegato, globuli sanguini, muscoli e arterie.
L'interesse per la dieta mediterranea (DM) è aumentato nel mondo nel corso del l'ultimo decennio, anche nei nutrizionisti al di fuori del bacino mediterraneo. Questo è in gran parte dovuto al fatto che la DM è stata associata a una più grande longevità, una migliore qualità di vita e a una riduzione dell'incidenza delle malattie cardiovascolari, del cancro e del declino cognitivo legato all'età (Trichopoulou e al., 2003; Trichopoulou e al., 2005), malgrado sia un modello alimentare ricco di grassi, contrariamente alle diete raccomandate per vari decenni da numerosi esperti in nutrizione in altre zone geografiche. Tuttavia, la fonte principale della materia grassa nella DM (fig. 15) deriva da un solo componente alimentare, ovvero l'olio d'oliva, il che significa che
Figura 15. Principali componenti dell'Alimentazione mediterranea.
l'alimentazione è povera di grassi saturi e ricca in acidi grassi mono e polinsaturi, in particolare in acido oleico. Durante questi ultimi anni, grazie a delle tecnologie moderne, altri tipi di oli con una composizione in materie grasse simili sono diventate disponibili per la nutrizione umana. Si tratta in particolare degli oli ottenuti da certi tipi di semi, di cui certe varietà sono ricche di acido oleico, come il girasole, la soia e il colza oleico. Questa situazione ha generato un nuovo concetto di DM, secondo il quale l'acido oleico non proviene necessariamente dall'olio di oliva, ma anche a partire da altri tipi di oli. La dieta mediterranea è stata associata ad un basso consumo di carne, fonte di acidi grassi saturi, e ad una ricchezza in acidi grassi monoinsaturi di origine vegetale. Le ricerche hanno sottolineato l'importanza degli alimenti vegetali (compresi i glucidi e le fibre non digeribili) e dell'utilizzo regolare di olio d'oliva. Per quel che riguarda il sistema cardiovascolare, le proprietà benefiche dell'olio d'oliva sono state, fino a poco fa, esclusivamente riportate al suo livello elevato in acidi grassi monoinsaturi (AGMI), principalmente l'acido oleico. In effetti, maggiore la concentrazione in AGMI, maggiore la resistenza delle LDL all'ossidazione (Bonanome e al., 1992), comportando così la diminuzione di uno dei fattori di rischio di malattia coronarica (Witztum e Steinberg, 2001). A titolo di esempio, la FDA (Food and Drug Administration, USA) ha autorizzato un'asserzione di salute qualificata per gli AGMI dell'olio d'oliva e un rischio ridotto di malattia coronarica (FDA, P04-100, 2004). Tuttavia, diverse osservazioni perorano contro l'ipotesi dell'acido oleico come fattore esclusivo responsabile dell'abbassamento dei tassi di malattie cardiovascolari nella regione mediterranea. Per esempio, gli effetti degli AGMI sui lipidi e le lipoproteine circolanti non sono stati completamente chiariti, mentre i principali effetti degli AGMI sul colesterolo serico sono generalmente considerati come indiretti (Belkner e al., 1993; Hegsted e al., 1993; Gardner e Kraemer, 1995). Certi studi (Mensink e al., 2003) hanno provato l'effetto ipocolesterolemiante diretto, anche se modesto, degli AGMI solo quando rimpiazzano gli idrati di carbonio come fonte d'energia. Inoltre, gli AGMI aumentano il tasso delle lipoproteine di alta densità (HDL) più che gli acidi grassi polinsaturi (AGPI) quando queste due classi di acidi grassi rimpiazzano i glucidi nella dieta alimentare (Mensink e al., 2003). Tuttavia, i benefici del consumo di olio di oliva vanno al-dilà di una semplice riduzione del colesterolo e delle lipoproteine a bassa densità. Gli effetti biologici e clinici i più importanti legati all'alimentazione ricca di AGMI (in particolare l'acido oleico) sul metabolismo delle lipoproteine, i danni ossidativi, l'infiammazione, la disfunzione endoteliale, la pressione arteriosa, la trombosi, e il metabolismo dei glucidi sono stati studiati da diversi autori (Covas, 2009 ; Huang e al., 2008). Tuttavia, l'acido oleico è uno degli acidi grassi predominanti negli alimenti di origine animale di largo consumo, come il pollame e il maiale. Così, contrariamente a quel che si pensa comunemente, la percentuale di acido oleico nell'alimentazione mediterranea è solo leggermente superiore a quello degli altri tipi di alimentazione occidentali, e per esempio, in Nord America (Dougherty e al., 1987 ; Katan, 1995). È dunque poco probabile che l'acido oleico sia esclusivamente responsabile delle proprietà benefiche dell'olio d'oliva. Infine, è altrettanto interessante notare che vari oli di semi ottenuti per selezione genetica, disponibili nel commercio, come girasole, soia e gli oli di colza sono oggi ricchi di acidi grassi monoinsaturi ma sprovvisti di composti fenolici. Questi oli non hanno lo stesso effetto di quello dell'olio d'oliva sulla riduzione del colesterolo e delle lipoproteine a bassa densità (Owen e al., 2000; Gunstone, 2004).
Se l'acido oleico fosse dotato d'importanti effetti cardioprotettori, a bassa incidenza di malattie cardiovascolari e di grande longevità, ciò sarebbe osservato anche all'esterno del bacino mediterraneo dove il consumo di olio di oliva è abbastanza basso.
Questo capitolo passa in rassegna gli elementi di prova che indicano come i composti fenolici dell'olio d'oliva extra vergine giochino un ruolo nella protezione e il trattamento delle malattie cardiovascolari, del cancro, così come di altre patologie nella regione mediterranea.
II. I polifenoli dell'olio d'oliva sono molto biodisponibili e bioattivi
Si definisce biodisponibilità la frazione di una sostanza che l'organismo è in grado di assorbire ed utilizzare per le proprie funzioni fisiologiche. Così, è importante conoscere non solo la quantità giornaliera di polifenoli ingerita, ma anche la loro biodisponibilità, visto che la loro qualità nutrizionale e i loro effetti sistemici dipenderanno del loro assorbimento a livello del tratto digestivo.
1. Assorbimento dei composti fenolici
I composti fenolici dell'olio d'oliva non sono tossici e il loro assorbimento dipende dalla dose somministrata. Questi composti sono molto biodisponibili in quanto componenti naturali dell'olio d'oliva.
Bai e al. (1998) hanno segnalato che la somministrazione orale dell'Idrossitirosolo a dei ratti ha comportato la sua apparizione rapida nel sangue, con delle concentrazioni massime ottenute nelle 5-10 min seguenti. L'Idrossitirosolo viene completamente eliminato e/o metabolizzato dopo 180 min dalla somministrazione. Visioli e i suoi collaboratori (2000) hanno studiato l'assorbimento dei composti fenolici dell'olio d'oliva nell'uomo. Sei uomini volontari (dai 27 ai 33 anni) hanno ricevuto 50 ml da quattro campioni d'olio d'oliva ricca d'Idrossitirosolo (OLIVIE Plus 30x). Dopo 24 h, le urine sono state analizzate e i risultati hanno mostrato che il rapporto tirosolo/Idrossitirosolo nelle urine è simile a quello presente nell'olio d'oliva (~ 1,7). Secondo i risultati di questi autori, il tasso di escrezione urinaria di tirosolo e di Idrossitirosolo dipende della dose somministrata. I dati suggerisono che i composti fenolici semplici come il tirosolo e l'Idrossitirosolo sono assorbiti dopo somministrazione e sono eliminati sotto forma di glucuronidi coniugati. In un altro studio, l'analisi delle urine ha rivelato la presenza di due altri metaboliti dell'Idrossitirosolo, l'acido omovanillico (4 -idrossi-3-metossi acido fenilacetico) e l'omovanillyl (Caruso e al., 2001).
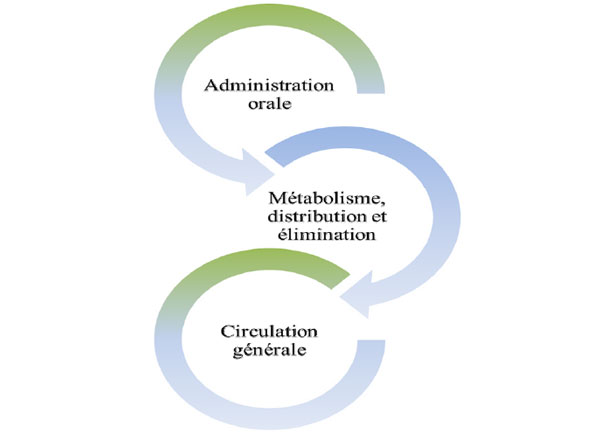
Figura 16. Biodisponibilità di una sostanza chimica.
In un altro studio sulla biodisponibilità, Tuck e al. (2001) hanno esaminato l'assorbimento e l'eliminazione di Idrossitirosolo e del tirosolo radiomarcati, in ratti Sprague- Dawley maschi. Dopo iniezione endovenosa (in soluzione salina) e somministrazione orale (in olio d'oliva e in una soluzione acquosa), per i due composti, la via endovenosa e la somministrazione per via orale in un supporto oleoso hanno comportato un'eliminazione significativamente più importante nelle urine dopo 24 ore, che quando questi composti sono stati somministrati oralmente in soluzione acquosa. Per il tirosolo e l'Idrossitirosolo, non c'era nessuna differenza significativa in quanto alla quantità eliminata nelle urine dopo iniezione endovenosa e la somministrazione orale in una soluzione oleosa. L'analisi dei campioni di urina ha rivelato la presenza dell'Idrossitirosolo e di cinque altri metaboliti. La stima della biodisponibilità orale dell'Idrossitirosolo, quando è somministrato in una soluzione di olio d'oliva e in una soluzione acquosa era rispettivamente di 99% e 75% (fig. 17a), mentre la stima della biodisponibilità del tirosolo era di 98 % e 71 % (fig. 17b).
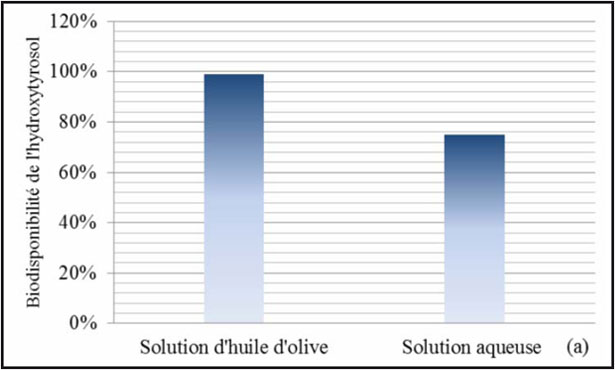
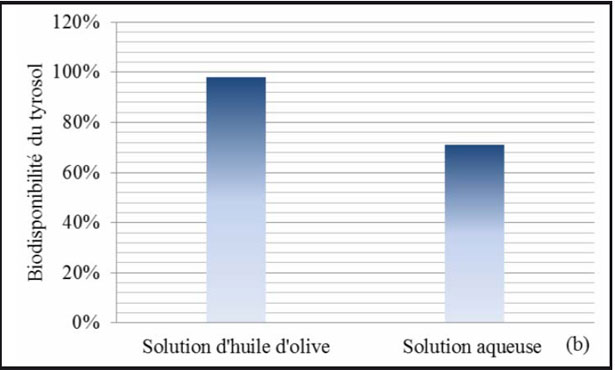
Figura 17. Biodisponibilità dell'Idrossitirosolo (a) e di tirosolo (b) in funzione del supporto di trasporto.
In 2003 gli stessi autori Visioli e al., hanno confermato i loro risultati sull'Uomo. Hanno paragonato l'escrezione dell'Idrossitirosolo nell'Uomo, quando è consumato come componente naturale dell'olio d'oliva extra vergine e quando è aggiunto all'olio d'oliva raffinato e lo yogurt. L'eliminazione dell'Idrossitirosolo era molto più elevata dopo la sua somministrazione come componente naturale dell'olio d'oliva (44,2 % d'Idrossitirosolo) che dalla sua somministrazione nell'olio raffinato (23 % d'Idrossitirosolo) o nello yogurt (5,8 % d'Idrossitirosolo) (fig. 18). Il tasso elevato dell'escrezione testimonia del grado elevato di assorbimento dell'Idrossitirosolo.
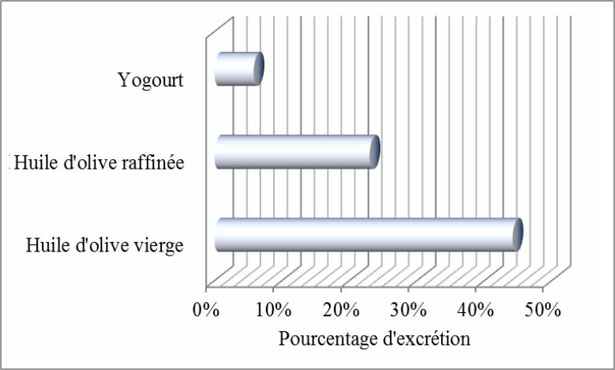
Figura 18. Escrezione urinaria dell'Idrossitirosolo in funzione del veicolo di trasporto.
In un altro studio, otto volontari sani hanno ingoiato 100g di olio d'oliva extra vergine, i campioni di sangue sono stati raccolti a diversi momenti dopo l'ingestione. I ricercatori hanno concluso che i composti fenolici dell'olio d'oliva sono stati assorbiti a livello intestinale, tuttavia, attraverso una via indipendente della formazione dei chilomicroni (lipoproteine che si formano durante la digestione, responsabili del trasporto dei lipidi dall'intestino tenue verso i tessuti adiposi periferici dove si sono ritirati). Questi composti possono esercitare un effetto antiossidante importante in vivo, probabilmente in fase post-prandiale (Bonanome e al., 2000). In un altro studio sull'assorbimento supplementare dei polifenoli dell'olio vergine in soggetti affetti da ileostemia,Vissers e al. (2001) hanno segnalato che questi composti sono essenzialmente assorbiti a livello dell'intestino tenue. L'assorbimento è stato confermato dall'escrezione del tirosolo e dell'Idrossitirosolo nelle urine. È stato stimato che l'assorbimento apparente dei composti fenolici arrivavano almeno al 55-66 % della dose ingerita. In uno studio quantitativo, Ruiz-Gutierrez e al., (2000) hanno segnalato che il tasso d'Idrossitirosolo nel sangue è stimato a 5 % dopo 5 min dalla somministrazione. Manna e al. (2000) hanno studiato i meccanismi molecolari del trasporto intestinale dell'Idrossitirosolo, utilizzando le cellule Caco-2 Monostrato differenziate come modello dell'epitelium intestinale umano. I dati cinetici suggeriscono che il trasporto del [14C]- Idrossitirosolo si fa mediante un meccanismo di diffusione passiva ed è bidirezionale. Il valore del coefficiente della permeabilità apparente calcolata suggerisce che l'Idrossitirosolo è al 100 % assorbito a livello intestinale. Questi dati forniscono la prova che l'Idrossitirosolo è altamente biodisponible.
2. Metabolismo
Dopo la somministrazione endovenosa del [14C]-Idrossitirosolo a dei ratti è risultato che meno dell'8% della radioattività somministrata era presente nel sangue 5 min dopo l'iniezione (6 % legato al plasma e 2 % alla frazione di cellule). Soltanto l'0,1 % della dose somministrata corrispondeva a dell'Idrossitirosolo rilevabile nel sangue 5 ore dopo la somministrazione. Circa 90% della radioattività somministrata è stata rilevata nelle urine durante le 5 ore seguenti, mentre circa 5% nelle feci e nel contenuto gastrointestinale. L'[14C]-Idrossitirosolo è stato enzimaticamente convertito in quattro derivati ossodati e/o metilati. Una frazione significativa della radioattività totale è stata associata a delle forme solfo-coniugate, il che ha anche rappresentato i principali prodotti dell'escrezione urinaria. Sulla base di questi risultati, vari autori (fig. 19) hanno proposto una via metabolica della somministrazione esogena dell'Idrossitirosolo implicando la catecol-o-metiltrasferasi, l'aldeide disidrogenase e la fenolsolfotrasferasi (D'Angelo e al., 2001).
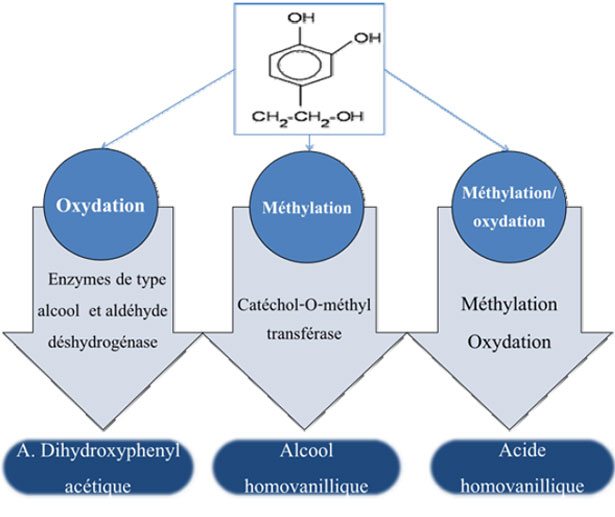
Figura 19. Principali vie di metabolismo dell'Idrossitirosolo nell'Uomo proposte da D'Angelo e al., (2001).
Tre gruppi di ratti Sprague-Dawley maschi sono stati ingozzati con 1,5 o 10 mg / kg di estratto di acqua di vegetazione, fornendo rispettivamente 41,4; 207 e 414 μg/kg d'Idrossitirosolo. L'Idrossitirosolo è stato assorbito ed eliminato nelle urine, principalmente sotto forma di glucuronide coniugato. Circa il 25% della dose totale d'Idrossitirosolo somministrata è stato ritrovato nelle urine (forma libera e coniugata al glucuronide). Caruso e al. (2001) hanno esaminato la via metabolica dell'Idrossitirosolo dopo ingestione di olio d'oliva vergine (50 ml, contenendo 7 a 23 mg d'Idrossitirosolo totale) a sei soggetti volontari sani di sesso maschile. I risultati suggeriscono che il metabolismo dell'Idrossitirosolo necessita dell'enzima catecol-o-metiltrasferasi. In sintesi, vari ricercatori hanno provato la grande biodisponibilità dell'Idrossitirosolo nell'Uomo dopo somministrazione orale di olio d'oliva. Questi studi hanno dimostrato la presenza di Idrossitirosolo nel sangue e nelle urine. È da notare che, l'oleuropeina, che è ugualmente presente nell'olio d'oliva, può essere assorbita e idrolizzata in Idrossitirosolo.
3. Escrezione
Visioli e al. (2003) hanno studiato l'escrezione urinaria dell'Idrossitirosolo libero e congiunto nei ratti e nell'Uomo dopo somministrazione di olio d'oliva. I risultati di questo studio indicano che dopo 24 ore dalla somministrazione, l'Uomo espelle il 31% d'Idrossitirosolo, mentre i ratti ne espellono soltanto il 5%. In uno studio successivo, Miro-Casas e al. (2003b) hanno rapportato un aumento della concentrazione d'Idrossitirosolo dopo ingestione di un dose unica (50 ml) e al consumo a breve termine (25 ml / giorno per una settimana) d'olio d'oliva vergine per sette soggetti in buona salute. Miro-Casas e al. (2003a) hanno anche segnalato un aumento della concentrazione di Idrossitirosolo e del 3-O-metil-Idrossitirosolo nel plasma in seguito all'ingestione di olio d'oliva vergine (25 ml) nell'Uomo, raggiungendo concentrazioni massime rispettivamente dopo 32 e 53 min. La stima dell'emivita dell'eliminazione dell'Idrossitirosolo era di 2,43 h, mentre la concentrazione massima era di 26 µg/l. Sulla base dei risultati di questo studio, circa il 98% dell'Idrossitirosolo sembra essere presente nel plasma e l'urina sotto forma coniugata, principalmente ai glucuronidi, suggerendo un primo passaggio intestino/fegato del metabolismo dell'Idrossitirosolo ingerito. In un'inchiesta seguente sui campioni di urina dello studio sull'assorbimento, Tuck e al. (2002) hanno identificato tre metaboliti d'Idrossitirosolo con spettroscopia di massa (MS/MS in tandem) cioè, il coniugato monosolfato, il coniugato 3-O-glucuronide e l'acido 4-idrossi-3-metossifenilacetico (acido omovanillico). Tuck e Hayball (2002) hanno segnalato che l'Idrossitirosolo è espulso dai reni sotto forma libera e anche coniugata ai composti seguenti: glucuroconide, solfato, acido omovanillico, l'alcol omovanillyl, l'acido 3,4-diidrossifenilacetico e il 3,4-diidrossifenilacetaldeide.
III. Potere antiossidante dei polifenoli dell'olio d'oliva
L'omeostasi a livello cellulare e, sopratutto a livello dell'organismo, corrisponde all'equilibrio, tra la formazione delle specie ossigenate e azotate altamente reattive e l'azione degli antiossidanti che mantengono dei tassi accettabili di queste sostanze e minimizzano le loro reazioni non specifiche con le biomolecole (acidi nucleici, proteine, acidi grassi ecc.) (fig. 20) che condurrebbero all'apparizione di malattie degenerative (per esempio, l'aterosclerosi, il cancro, il diabete, l'artrite reumatoide e le malattie infiammatorie), (Pérez- Jiménez, 2006). Un radicale libero è una specie chimica, atomo o molecola, contenente un elettrone non accoppiato. Estremamente instabile, questo composto può reagire con le molecole
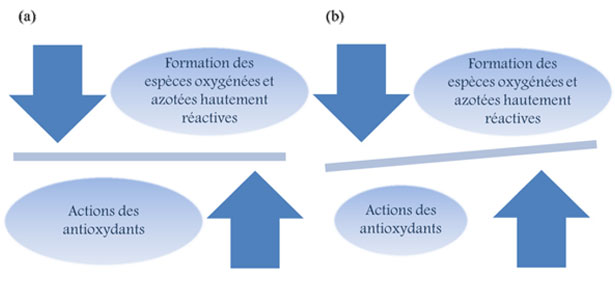
Figura 20. Equilibrio tra la formazione e l'eliminazione delle specie ossigenate e azotate altamente reattive, (a) caso normale e (b) in caso dello stress ossidativo.
più stabili per appaiare il suo elettrone. Ha la possibilità di strappare un elettrone (comportandosi come un ossidante), o cederne uno (agendo allora come riduttore). Questa prima reazione conduce generalmente alla formazione a catena di nuovi radicali; questo spiega che la produzione di un primo radicale libero possa causare importanti lesioni in una cellula. L'ossigeno è una molecola biradicolare formata da due atomi presentando sulle loro orbite esterne due elettroni non appaiati. È dunque probabile che capti facilmente 1 poi 2 elettroni per essere parzialmente ridotto in O2•- poi in H2O2. È così all'origine della formazione di specie reattive ossigenate (Reactive Oxygen Species : ROS), radicale idrossilo (OH•). L'appellazione ROS include i radicali liberi dell'ossigeno (fig. 21 : anione superossido O2•-) ma anche certi derivati ossigenati non radicalari la cui tossicità è importante quali il perossido di idrogeno (H2O2).
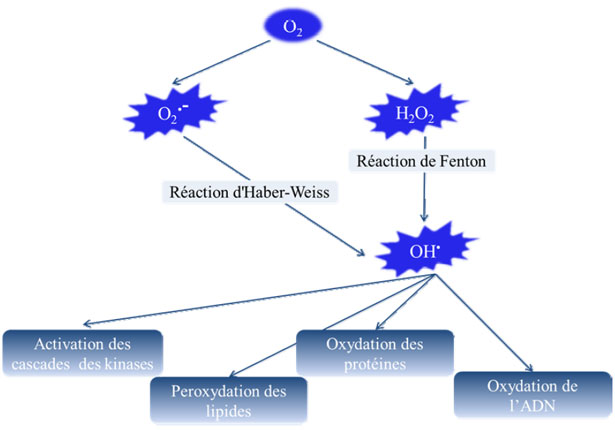
Figura 21. Schema di diverse forme di ROS (Gutteridge e Halliwel, 1992).
L'anione superossido è un radicale caricato negativamente proveniente dalla riduzione monovalente dell'ossigeno molecolare che capta un elettrone. La dismutazione di quest'O2.- comporta la formazione di ossigeno fondamentale e di perossido d'idrogeno H2O2. Questo non è veramente un radicale libero ma è estremamente reattivo e possiede un forte potere ossidante. In più, la sua capacità di attraversare le membrane biologiche fa sì che può ritrovarsi ad una grande distanza dal suo luogo di produzione. Secondo la reazione di Fenton, l'H2O2 si decompone, in presenza d'ioni ferrosi (Fe2+), in un ione OH- e un radicale idrossilo:
![]()
Questa reazione s'interrompe rapidamente per esaurimento del ferro ferroso, eccetto in presenza di anioni superossido che rigenera Fe3+ in Fe2+ secondo la reazione di Haber-Weiss:
![]()
Così, la presenza simultanea di perossido d'idrogeno, di anione superossido e di ferro permette la produzione di radicale idrossilo. L'OH•, con un'emivita dell'ordine del nanosecondo, è la più instabile e la più reattiva di tutte le specie derivate dall'ossigeno. La diffusione limitata di questo radicale gli permette di reagire con numerose specie molecolari trovandosi a prossimità (proteine, lipidi, DNA...) comportando numerosi danni cellulari. L'OH• appare come la specie radicale che ha un ruolo maggiore nella citotossicità dei ROS (Gutteridge e Halliwell, 1993).
Un antiossidante può essere definito come una sostanza che, quand'è presente in basse concentrazioni rispetto a quelle di un substrato ossidabile, ritarda considerevolmente o impedisce l'ossidazione di questo substrato. (Halliwel e al., 1999).
1. Sistemi antiossidanti enzimatici
Gli antiossidanti enzimatici (fig. 22) (il superossido dismutasi, la catalasi, il glutatione perossidasi e il glutatione riduttasi) sono considerati come la prima linea di difesa del nostro organismo contro i ROS.
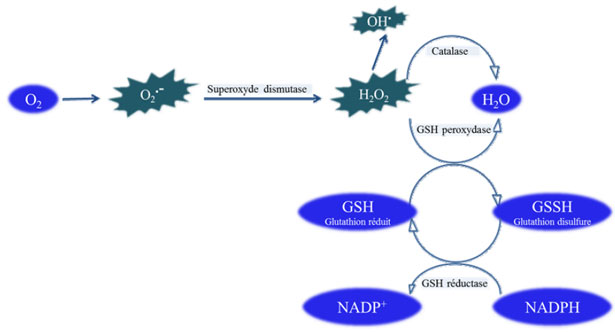
Figure 22 Schema delle difese antiossidanti enzimatiche.
2. Sistemi antiossidanti non enzimatici
Chelanti biologici dei metalli: impediscono la partecipazione degli ioni metallici transitori nella formazione del radicale idrossilo e altre sostanze altamente reattive.
Molecole che fermano la propagazione dell'ossidazione: questa classe di molecole agisce quando una reazione di ossidazione è iniziata a discapito della presenza di questi sistemi biologici antiossidanti. È una vasta categoria di molecole che gioca un ruolo cruciale nel processo di lotta contro le specie altamente reattive. Questa classe comprende diverse sostanze idrofile e idrofobe a basso o alto peso molecolare, ossia:
- I polifenoli (olio d'oliva),
- I tocoferoli, vitamina E (olio d'oliva),
- I carotenoidi (olio d'oliva),
- L'acido ascorbico (vitamina C),
- Il glutatione,
- Certi acidi aminati (quali la cisteina, metionina, o la tirosina),
- L'acido urico.
I principali modi di azione di questa classe di antiossidanti è di reagire con i radicali liberi per formare dei radicali meno reattivi, incapaci di reagire con le biomolecole, o per riparare chimicamente un bersaglio danneggiato. Di conseguenza, questa classe di composti è spesso chiamata “scavenger” di radicali liberi.
L'olio d'oliva contiene ben più sostanze protettrici a grande effetto antiossidante che il vino, il tè verde e la vitamina C. i radicali liberi sono intrappolati efficacemente dai polifenoli dell'olio d'oliva il che spiega i loro grande potere antiossidante.
GGli antiossidanti esogeni hanno una doppia funzione; impediscono l'ossidazione degli alimenti, in particolare i lipidi, e allo stesso tempo aumentano il tasso di antiossidanti endogeni, il che corrisponde a una protezione contro le malattie degenerative. Gli antiossidanti dietetici i più importanti sono certe vitamine (acido ascorbico, i tocoferoli, caroteni) e i composti fenolici, che sono presenti i diversi alimenti di origine vegetale caratteristici della dieta mediterranea, come l'olio d'oliva (Edwin e al. 2011).
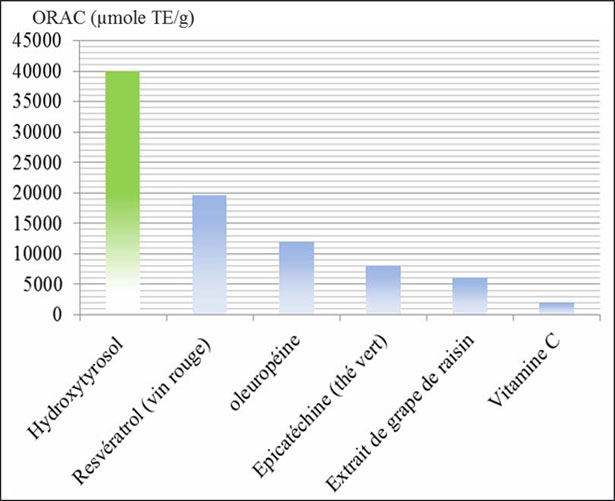
Figure 23. Potere antiossidante dell'Idrossitirosolo (composto fenolico maggiore dell'olio d'oliva) rispetto ad altri antiossidanti. ORAC: Capacità di Assorbire i Radicali Ossigenati.
3. I polifenoli dell'olio d'oliva, composti a forte potere antiossidante
I composti fenolici possono agire come antiossidanti in diverse maniere. Nei sistemi che utilizzano l'ossidazione dei metalli di transizione quali il rame e il ferro, possono chelare questi ioni metallici, che sono degli iniziatori di reazioni di Fenton dato che possono generare forte concentrazioni nel radicale idrossilo (fig. 21) (Halliwell & Gutterige, 1990; Halliwell e al. 1995). Tuttavia, l'attività antiossidante più importante è legata alla capacità antiradicalare, rompendo la catena delle reazioni scatenate dai radicali liberi. La proprietà antiossidante dei polifenoli è associata alla loro capacità di formare dei legami idrogeno intramolecolare tra il gruppo idrossilo e i radicali fenossilici (Visioli & Galli., 1998b). Degli studi simili sui flavonoidi hanno già dimostrato che il grado dell'attività antiossidante è correlata al numero di gruppi idrossili (Rice-Evans e al., 1996; Cao e al., 1997). Il numero di gruppi idrossili e le loro posizioni sul ciclo aromatico sono determinanti per l'attività dei flavonoidi e dei polifenoli. Lo studio delle strutture di risonanza formate nel corso dei processi di ossidazione ha permesso di rivelare che i composti orto e para sostituiti sono più stabili che i meta sostituiti (Finotti e Di Majo, 2003). In particolare, la sostituzione orto-difenolica favorisce un'alta capacità antiossidante, mentre una sola sostituzione idrossile, come per il tirosolo, non conferisce una forte attività, dal momento che il tirosolo non protegge contro l'ossidazione indotta chimicamente delle lipoproteine a bassa densità (LDL). Benché l'olio d'oliva contenga una concentrazione relativamente bassa in α-tocoferolo, è riconosciuta essere molto resistente al degrado ossidativo. Ciò è dovuto, in parte , al tenore relativamente basso in acidi grassi polinsaturi, ma sopratutto, all'alto tenore in composti fenolici. L'attività antiossidante dei composti fenolici dell'olio d'oliva, e in particolare dell'Idrossitirosolo e dell'oleuropeina, è stata studiata in numerosi modelli sperimentali con utilizzazione di metalli di transizione; l'ossidazione delle LDL indotta chimicamente; la formazione dei ROS, per esempio il radicale superossido, il radicale triclormetilperossilico e l'acido ipocloroso (Aeschbach e al. 1994; Salami e al. 1995; Visioli e al. 1995a, 1998; Aruoma e al. 1998). Stimando l'attività antiossidante di questi composti polifenolici sulla base della loro capacità ad inibire la formazione dei perossidi, è stato dimostrato che l'acido caffeico, l'Idrossitirosolo e l'acido protocatechuico hanno una più grande attività antiradicalare (Papadopoulos & Boskou, 1991). L'attività antiossidante dell'oleuropeina e dell'Idrossitirosolo è stata dimostrata su dei modelli cellulari e animali (Manna e al. 1997; Speroni e al. 1998).
Keceli e Gordon (2001), hanno comparato l'attività antiossidante dell'α-tocoferolo e dei composti fenolici estratti a partire di olive e di olio di oliva nel tempo. È stato dimostrato che nei primi 15 minuti, l'attività dell'α-tocoferolo è stata più elevata, ma cala rapidamente. L'estratto di olive e di olio di oliva continuano a ridurre più lentamente la concentrazione dei radicali; dopo 60 minuti, gli estratti di olive e di olio d'oliva sono stati molto più attivi che l'α-tocoferolo. Questa attività si estende fino al sesto giorno.
Gli effetti dell'attività antiossidante dei polifenoli dell'olio d'oliva sull'integrità e la funzione delle cellule sono stati studiati sugli eritrociti e le cellule intestinali (Caco-2). La capacità dei polifenoli a prevenire i danni nelle cellule è stata verificata durante la loro esposizione a uno stress ossidativo, in presenza di H2O2. Gli eritrociti umani sono stati scelti perché sono le cellule le più esposte al rischio ossidativo, visto che il loro ruolo specifico è di trasportare ossigeno. Il bersaglio principale del H2O2 è l'emoglobina, che viene ossidata in metemoglobina. L'ossidazione spontanea dell'emoglobina produce dei radicali di anioni superossido che causano la dismutazione del H2O2 (fig. 21). In presenza d'ioni metallici ridotti, in particolare il ferro, questi composti formano un radicale idrossilo altamente reattivo che può danneggiare la membrana cellulare causando così l'emolisi delle cellule (Sadrzadeh e al., 1984; Van Dyke & Saltman, 1996). Nelle condizioni fisiologiche normali, i ROS sono rapidamente eliminati dai due sistemi enzimatici e non enzimatici; tuttavia, se la produzione dei ROS è eccessiva o se la difesa antiossidante è indebolita, possono prodursi gravi danni ossidativi, tanto a livello della membrana plasmica che a livello del citosolo, il che conduce, da ultimo, all'emolisi.
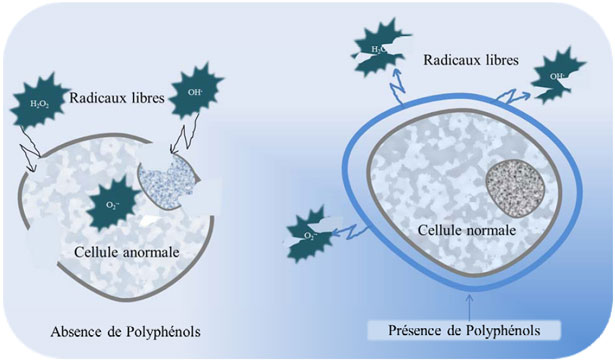
Figura 24. Schema esplicativo dell'effetto protettivo dei polifenoli dell'olio d'oliva contro i radicali liberi.
Gli eritrociti pretrattati dai composti fenolici estratti dall'olio extra vergine resistono all'ossidazione dei lipidi e all'emolisi dopo uno stress ossidativo indotto con H2O2. L'Idrossitirosolo impedisce l'alterazione del trasporto degli acidi aminati dal H2O2 negli eritrociti intatti (Manna e al. 1999). Allo stesso modo nelle cellule di tumore intestinale (Caco-2) trattati con H2O2, pretrattando con polifenoli l'olio d'oliva, si ha un effetto antiossidante potente. La preincubazione delle cellule Caco-2 con Idrossitirosolo impedisce totalmente le alterazioni indotte dal H2O2 (Manna e al. 1999).
IV. L'olio d'oliva ricco di polifenoli, il suo effetto contro l'invecchiamento. L'Idrossitirosolo, potente composto fenolico dell'olio d'oliva, aumenta la produzione di mitocondri. Il numero elevato di mitocondri nella cellula è un indicatore della giovinezza del corpo e della buona salute.
L'invecchiamento è un processo fisiologico complesso attraverso il quale le funzioni di diversi organi del sistema si deteriorano (Sung e al., 2005). Diversi autori hanno dimostrato che i cambiamenti e i danni legati all'età sono direttamente legati allo stress ossidativo e alle reazioni infiammatorie innescate dai radicali liberi che sono delle specie chimiche altamente reattive (Sung e al., 2005). Questi danni si notano di più a livello dei mitocondri, organiti onnipresenti nelle cellule, sede di reazioni di ossidoriduzioni, che produce energia convertendo gli elementi nutritivi in adenosina trifosfato (ATP), molecole che sono utilizzate per il funzionamento normale e il mantenimento delle cellule. I mitocondri sono anche implicati nelle regolazione della sopravivenza cellulare. Di recente, è stato suggerito che la perdita della funzione mitocondriale non solo contribuisce a l'insorgenza di malattie, ma gioca anche un ruolo importante nel processo dell'invecchiamento (Raederstorff e al., 2010). Una diminuzione del numero di mitocondri in certi organi e un'alterazione della catena respiratoria mitocondriale è spesso associata al processo d'invecchiamento ed è considerato come un fattore principale dell'invecchiamento (Hao e al., 2010). Dei soggetti sani dai 65 ai 75 anni presentano dei segni di modificazione delle proprietà dei mitocondri caratterizzata da una perdita dell'attività enzimatica ossidativa mitocondriale e il contenuto dei tessuti (Raederstorff e al., 2010). Inoltre, i tessuti provenienti di animali vecchi dimostrano dei cambiamenti nella struttura mitocondriale associata a una bassa produzione di energia. Così, l'invecchiamento è associato a una biogenesi mitocondriale ridotta e un accumulo di danni mitocondriali.
1. Effetto positivo dell'Idrossitirosolo sulla biogenesi mitocondriale
La biogenesi mitocondriale si riferisce a dei processi di crescita, di amplificazione e di mantenimento del mitocondrio. È un processo complesso che implica allo stesso tempo attori nucleari e mitocondriali. Il DNA mitocondriale codifica un piccolo numero di proteine, che sono tradotte sui ribosomi dei mitocondri. La maggior parte di queste proteine sono le sottounità idrofobe della catena respiratoria, che è localizzata nella membrana mitocondriale interna. Ora, la maggior parte delle proteine mitocondriali sono codificate dal DNA nucleare e tradotte sui ribosomi citosolici, poi trasportate verso le mitocondri. Queste proteine comprendono delle proteine di struttura, degli enzimi o delle sottounità di enzimi, dei composti della replicazione, della trascrizione, della traduzione e le proteine controllori. Il PGC-1α (peroxisome proliferator activator receptor ϒcoactivator-1α) è un fattore di regolazione co-trascrizionale del metabolismo energetico cellulare che è implicato nella biogenesi mitocondriale, e di conseguenza, di controllo della funzione mitocondriale. La diminuzione del PGC-1α nei tessuti invecchiati è un fattore chiave nella disfunzione mitocondriale che può essere prevenuta con un aumento del PGC-1α conducendo a un aumento della biogenesi mitocondriale. Raederstorff e i suoi collaboratori hanno provato che l'Idrossitirosolo migliora la funzione mitocondriale grazie all'attivazione dei complessi di catena respiratoria mitocondriale e l'aumento della biogenesi mitocondriale inducendo l'espressione del fattore PGC-1α. Nello stesso senso, Hao e i suoi colleghi (2010) hanno dimostrato che una concentrazione da 0.1 a 10 µmol/l d'Idrossitirosolo ha stimolato l'espressione del fattore PGC-1α e i suoi bersagli a valle, il che conduce a un aumento del DNA mitocondriale (ADNmt) e del numero di mitocondri negli adipociti 3T3-L1. Così, un miglioramento della funzione mitocondriale potrebbe prevenire l'invecchiamento cellulare, e di conseguenza, l'invecchiamento del corpo (fig. 25). In conclusione, l'Idrossitirosolo può essere considerato come un agente utile per prevenire l'invecchiamento e le malattie legate all'età.
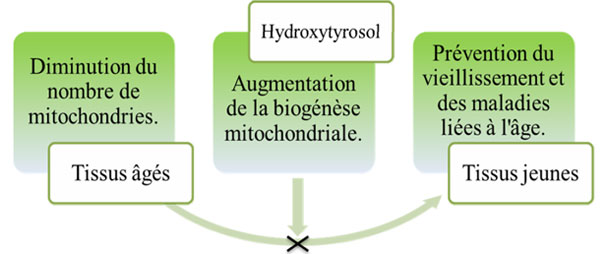
Figura 25. Effetto antinvecchiamento dell'Idrossitirosolo.
2. Effetto antinvecchiamento dei polifenoli dell'olio d'oliva sulle cellule cardiache
Mukherjee e i suoi collaboratori (2009), hanno studiato la capacità dell'Idrossitirosolo e del tirosolo, così come di altre fonti di polifenoli, a indurre l'espressione delle proteine legate alla longevità delle cellule cardiache. Le cellule cardiache dei ratti trattati con 2,5 mg/kg di tirosolo e d'Idrossitirosolo sono state isolate allo scopo di studiare il loro tenore in proteine. I risultati hanno provato la capacità del tirosolo e dell'Idrossitirosolo a indurre diverse proteine legate alla longevità (antinvecchiamento) delle cellule cardiache, compresi PBEF, SirTs, e FoxOs.
V. L'Idrossitirosolo e l'oleuropeina contro l'AIDS
L'oleuropina e l'Idrossitirosolo sono degli agenti utili per inibire la fusione e l'integrazione del HIV nelle cellule umane.
Al giorno d'oggi, 29 medicinali sono autorizzati negli Stati-Uniti dalla FDA (Food and Drug Administration) per il trattamento dell'infezione VIH-1 (Hammer, 2005). Questi agenti possono essere classati secondo il loro meccanismo d'azione: (i) inibitori della trascriptasi inversa (IRT), (ii) inibitori della proteasi (IP), (iii) inibitori della fusione. La combinazione degli IRT e degli IP, comunemente conosciuta con il nome di Trattamento Antiretrovirale Altamente Attivo (HAART) (Hammer, 2005; Cohen, 2002), ha considerevolmente ridotto la morbilità e la mortalità del malato, trasformando l'HIV/AIDS a una semplice malattia cronica. Anche se l'HAART può rallentare la progressione della malattia, non guarisce l'infezione HIV. Il trattamento antivirale deve essere mantenuto a lungo termine, il che conduce a l'apparizione di gravi tossicità croniche e alla resistenza ai medicinali. Ciò conduce i ricercatori a orientare i loro sforzi verso l'esplorazione di nuove droghe efficaci e non tossiche. In quest'ambito, Lee-Huang e al (2003) hanno rapportato che l'estratto di foglie di ulivo è efficace contro l'HIV-1. È stato provato che l'efficacia dell'estratto di foglie d'ulivo è dovuta alla presenza dell'oleuropeina e dell'Idrossitirosolo. Questi due composti, che abbondano nell'olio di oliva ricco di polifenoli, sono attivi a livelli di varie tappe del ciclo di vita del'HIV-1. Inibiscono la trasmissione del HIV-1 di una cellula all'altra e rallenta considerevolmente la moltiplicazione virale. Degli studi in vitro indicano che l'oleuropeina e l'Idrossitirosolo reagiscono con la parte idrofoba conservata sulla superficie della centrale trimerica superelica del complesso di fusione gp41 del HIV, il gruppo di sei elicoidali (6HB) e il dominio catalitico del sito attivo dell'integrasi. Di conseguenza, questi due composti hanno un effetto inibitore dosa-dipendente sulla formazione del complesso di fusione del HIV-1 con la cellula ospite, con un'EC50 (concentrazione necessaria per raggiungere il 50% dell'effetto) dell'ordine di 58-66 nM, senza tossicità rilevabile (Lee-Huang e al., 2007).
VI. L'Idrossitirosolo e i polifenoli dell'olio d'oliva, potenti anticancerogeni
Idrossitirosolo e polifenoli dell'olio d'oliva sono potenti protettori contro il cancro. Questi composti naturali sono anche eccellenti sostanze per il trattamento del cancro.1. Generalità
L'incidenza del cancro nei paesi mediterranei è più basso che nel resto dell'Europa e negli Stati-Uniti (Keys e al. 1981). Degli studi epidemiologici hanno dimostrato un basso tasso di cancro dell'intestino crasso, del seno, dell'endometrio e della prostata nel bacino mediterraneo, e la principale ragione per questo, al di fuori di possibili fattori genetici, è attribuita alle pratiche alimentari. La dieta mediterranea tradizionale è caratterizzata da un consumo elevato di alimenti di origine vegetale, un consumo relativamente basso di carni rosse e un forte consumo di olio d'oliva e i suoi prodotti. Ci sono un certo numero di studi che si sono interessati agli effetti benefici dell'olio d'oliva per la salute. Questi studi hanno riportato che i lipidi dell'olio d'oliva sono preventivi nei confronti del cancro rispetto ad altre forme di lipidi aggiunti in ragione dei lori elevati tenori in acidi grassi monoinsaturi (Owen e al. 2000a, b; Visioli e Galli, 2001). Una dieta alimentare contenente il 15% d'olio d'oliva potrebbe ridurre considerevolmente le lesioni precancerosi del seno e del colon nel ratto (Martin-Moreno e al. 1994; Corona e al. 2007; Paula e al. 2007). Tuttavia, la stessa quantità di olio di soia non ha avuto un tale effetto protettore (La Vecchia e al. 1998). Inoltre, l'incidenza del cancro al seno era del 70% in meno in un gruppo di ratti nutriti con olio d'oliva rispetto a un altro gruppo che ha consumato l'olio di cartame con le stesse condizioni sperimentali (Owen et al. 2000a, b). Questi dati suggeriscono che l'effetto preventivo dell'olio d'oliva contro il cancro non è solo attribuibile al tenore in materie grasse "buone".
2. Idrossitirosolo/Oleuropeina, polifenoli a forte effetto anticancerogeno
I composti minori dell'olio d'oliva possono partecipare alla protezione contro il cancro, com'è il caso dei composti fenolici dell'olio d'oliva. In quest'ambito, è stato dimostrato che l'Idrossitirosolo ha un effetto anticancerogeno su un adenocarcinoma del colon umano (cellule HT-29) e la leucemia promielocitare (cellule HL-60) (Fabiani e al. 2002, 2006), mentre l'oleuropeina inibisce la crescita delle cellule (Hamdi e Hamdi, 2005):
- LN-18, poco differenziati del glioblastoma (tumore primitivo del cervello il più frequente e il più aggressivo);
- TF-1a, eritroleucemia;
- 786-O, l'adenocarcinoma renale;
- RPMI-7951, melanoma maligno della metastasi di ganglio linfatico della pelle;
- LoVo d'adenocarcinoma colo rettale.
Anche se le proprietà anticancerogene dell'oleuropeina e dell'Idrossitirosolo sono state confermate in vitro su delle linee cellulari diverse, degli studi dei loro effetti protettivi contro il cancro al seno non sono stati dimostrati. Da allora numerosi studi epidemiologici suggeriscono la possibile correlazione tra il consumo di prodotti dell'ulivo e l'incidenza del cancro al seno.
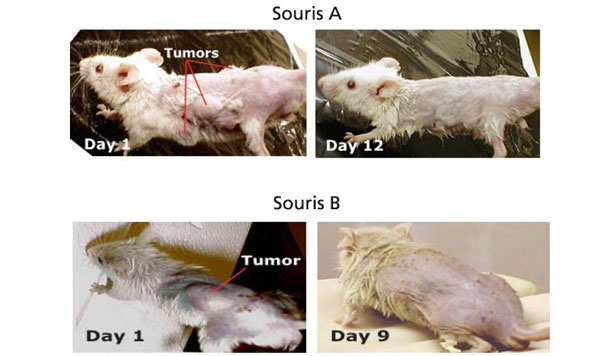
Figura 26. L'Idrossitirosolo glicolizzato induce una regressione tumorale in vivo. A dei topi portatori di tumori spontanei è stato somministrato 1% d'oleuropeina nell'acqua potabile. Certi topi hanno dei tumori multipli (rappresentato dal topo A), mentre altri portano una massa tumorale unica (rappresentato dal topo B). Dopo 9 a 12 giorni di trattamento, i tumori avevano completamente regredito (Hamdi e Hamdi e 2005).
3. Effetto efficace dell'Idrossitirosolo/Oleuropeina sul trattamento e la prevenzione del cancro al seno
Han e al, 2009 hanno studiato l'effetto antiproliferante e apoptotico dell'oleuropeina e dell'Idrossitirosolo (200 µg/ml e 50 µg/ml rispettivamente) sulle cellule MCF-7 del cancro al seno, i risultati (fig. 27) hanno mostrato che questi due prodotti:
- Diminuiscono la viabilità inducendo l'apoptosi delle cellule MCF-7;
- Inibiscono la proliferazione delle cellule MCF-7;
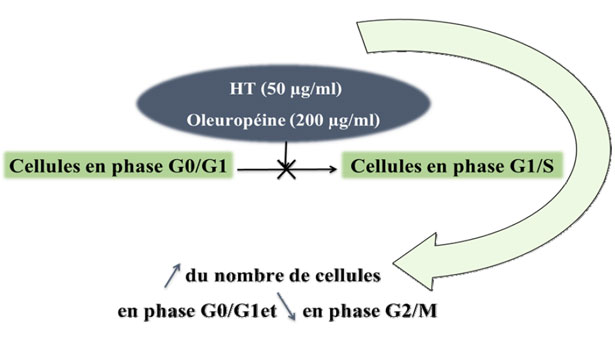
Figura 27. Effetto antiproliferante dell'Idrossitirosolo sulle cellule MCF-7 del cancro al seno.
Numerosi alimenti di origine vegetale contengono delle sostanze che possiedono delle proprietà anticancerogene (Huang e al. 1994; Johnson e al. 1994; Pezzuto, 1997), la maggior parte di loro sono attivi come antiossidanti (Aruoma, 1994). Dalla scoperta dell'implicazione dei ROS nella genesi dei tumori, lo studio dell'attività antitumorale dei composti fenolici dell'olio d'olia si è avverato primordiale. I perossinitriti (ONOO-) sono dei composti molto reattivi, capaci d'indurre la persossidazione dei lipidi, l'ossidazione della metionina e la lesione del DNA per disaminazione e nitrazione (Yermilov e al. 1995). I perossinitriti sono formati dalla reazione tra il monossido di azoto (NO) e l'anione superossido. La disaminazione della guaina e dell'adenina rompe la catena del DNA, il che porta allora all'apparizione di mutazioni (de Rojas-Walker e al. 1995); l'ossidazione del DNA è anche potenzialmente mutagena (fig. 28) (Newcomb & Loeb, 1998). In vitro, la presenza di Idrossitirosolo riduce gli effetti biochimici dei perossinitriti, quali la disaminazione dell'adenina e della guaina in certe linee cellulari (Deiana e al. 1999).
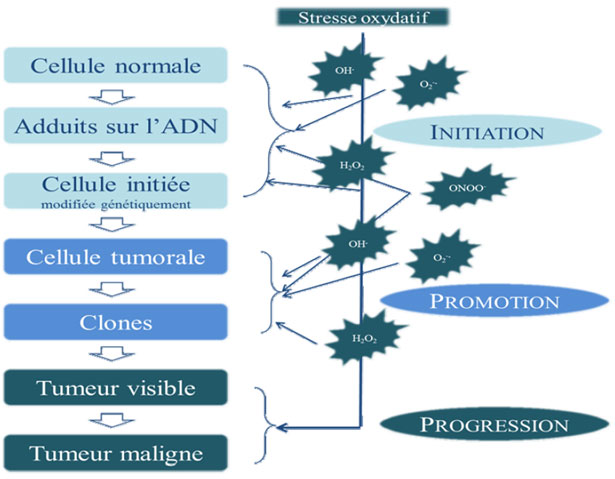
Figura 28. Effetto dello stress ossidativo sulle tre tappe della carcinogenesi.
In più di quest'azione, degli estratti di olio d'oliva vergine mostra un'azione inibitrice sull'attività della xantina ossidasi, con una riduzione conseguenza della formazione di superossido (Owen e al. 2000a). Un apporto adeguato di olio d'oliva ha dunque una doppia azione: dà una protezione contro gli effetti dei radicali di ossigeno e riduce l'attività della xantina ossidasi, un enzima potenzialmente implicato nella cancerogenesi (Tanaka et al. 19) Bernini e i suoi colleghi (2011) hanno sintetizzato un nuovo estere di Idrossitirosolo e di acido α-lipoico con un rendimento soddisfacente e con delle procedure semplici e originali. L'attività antiproliferativa di questo prodotto a base d'Idrossitirosolo è stata valutata sull'adenocarcinoma colo rettale umano, linea cellulare HT-29. Il composto ha mostrato un'attività inibitrice della crescita cellulare significativamente più potente dei composti parenti naturali corrispondenti, molto probabilmente dovuta all'induzione dell'arresto del ciclo cellulare in fase G2/M. Questi dati suggeriscono che il nuovo estere potrebbe esercitare un'attività antitumorale più efficace dell'Idrossitirosolo e dell'acido α-lipoico.
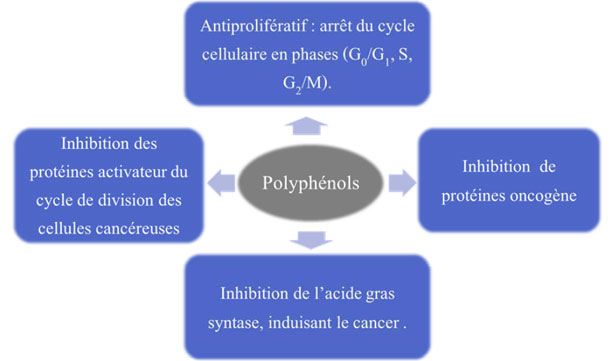
Figura 29. Altri effetti anticancerogeni dei polifenoli.
VII. Effetti protettivi dei polifenoli dell'olio d'oliva sul sistema cardiovascolare
L'olio d'oliva ricco di polifenoli permette la prevenzione e il trattamento delle malattie cardiovascolari. In effetti, i polifenoli dell'olio d'oliva favoriscono la riduzione della presenza delle molecole di aderenza cellulare, aumentano l disponibilità del monossido di azoto, sopprimono l'aggregazione piastrinica, stimolano i composti fenolici delle LDL per ritrdare l'arteriosclerosi e riducono le reazioni infiammatorie.1. Generalità
Le malattie non trasmissibili saranno responsabili di più dei tre quarti di tutti i decessi nel 2030 (Ortega, 2006). Le malattie cardiovascolari sono la prima causa di morbi-mortalità nel mondo, con un numero di decessi che aumenterà di 17,1 milioni nel 2004 a 23,4 milioni nel 2030 (Ortega, 2006). La cardiopatia ischemica è stata classata come la prima causa mondiale di mortalità nel 2004 e, purtroppo, nel 2030 nei paesi industrializzati (Ortega, 2006). Così, l'incidenza della mortalità per cardiopatia ischemica è ugualmente in rapida crescita nei paesi meno sviluppati. L'infarto acuto del miocardio costituisce una manifestazione catastrofica della cardiopatia ischemica e l'arterosclerosi coronarica. Dei tassi elevati, inaccettabili, di mortalità a causa dell'infarto acuto del miocardio esistono ancora in numerosi paesi sviluppati. Tuttavia, una bassa incidenza di queste malattie, stranamente, è osservata in diversi paesi del sud Europa come la Francia, la Spagna, la Grecia, l'Italia e il Portogallo, rispetto ai paesi nordici o gli Stati-Uniti (fig. 26.b). Questo contrasto contribuisce parzialmente a spiegare l'alta speranza di vita nelle regioni mediterranee. La dieta mediterranea è stata designata come il principale fattore responsabile (Menotti e al., 1997; Perez-Jimenez e al., 1999). Una delle caratteristiche le più importanti del RM è la presenza abbondante d'olio d'oliva come principale grasso culinario in questi paesi (fig. 26.a). Tuttavia, una varietà di fattori intervengono per la determinazione dei tassi di mortalità causati dalle malattie cardiovascolari, compresi le diverse diete alimentari regionali, la qualità della salute e lo statuto socio economico. È generalmente stabilito che la dieta finlandese basata su acidi grassi delle carni rosse, il burro e il pane favorisce molto le malattie cardiovascolari rispetto alla dieta mediterranea. Altri fattori, compresi i determinanti genetici, i livelli di stress, la natura delle attività quotidiane così come l'ambiente possono contribuire a queste disparità di salute osservate.
I paesi mediterranei, produttori e consumatori di olio d'oliva sono significativamente meno toccati dalle malattie cardiovascolari di quelli che non consumano quest'olio ad eccezione del Giappone. I giapponesi hanno una dieta alimentare ricca di polifenoli.
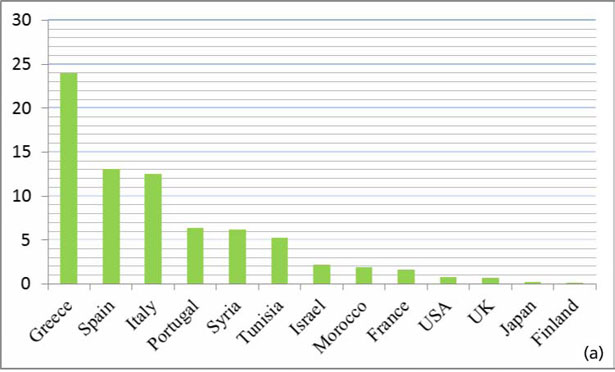
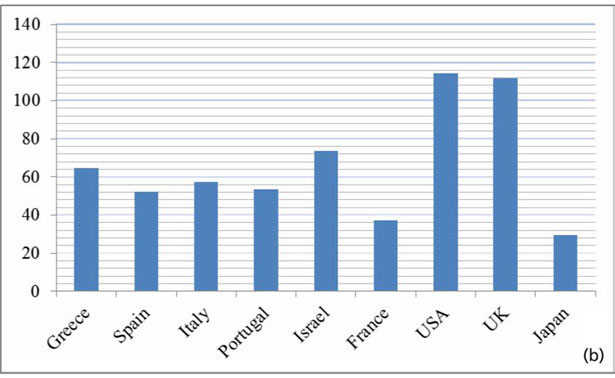
Figura 30. (a) Il consumo per abitante dell’olio d'oliva in certi paesi (Consiglio Oleicolo Internazionale). (b) Il tasso di mortalità per malattie cardiovascolari secondo l'Organizzazione Mondiale della Salute (malattie cardiovascolari Infobase) (Huang e al., 2008).
I polifenoli si oppongono alla catena di reazioni iniziate e sostenute dai radicali liberi. Questo impedisce i danni sul DNA, la formazione d'idroperossido e la perossidazione lipidica (Visioli e Galli, 1998; Katiyar e Mukhtar, 1996). Inoltre, gli antiossidanti esogeni aumentano la concentrazione di antiossidanti presenti nel corpo e proteggono contro le malattie degenerative (Visioli e al., 1995). I flavonoidi contribuiscono a risparmiare i livelli di base di β-carotene, urate (sali di acido urico) e le vitamine C ed E (Sumpio et al., 2006). I composti fenolici favoriscono la riduzione della presenza delle molecole di aderenza cellulare, aumentano la disponibilità del monossido di azoto (NO), sopprimono l'aggregazione piastrinica, stimolano i composti fenolici delle LDL per ritardare l'arteriosclerosi e riducono le reazioni infiammatorie (Perez-Jimenez, 2005).
2. Composti fenolici e prevenzione dell'aterosclerosi
L'aterosclerosi è una patologia infiammatoria della parete arteriale che risulta nell'aggressione iniziale dell'endotelium vascolare da una moltitudine di agenti di cui principalmente le lipoproteine aterogene (LDL, piccole- VLDL) e il fumo di tabacco. Secondo la classificazione dell'« American Heart Association » le placche arteriose possono presentare cinque fasi successive di evoluzione, identificate da un punto di vista istopatologico per sei tipi di placca. I due primi corrispondono all'assorbimento delle LDL ossidate (Ox-LDL) dai macrofagi sottoendoteliali e alla formazione di cellule spumose (tipo I), la cui accumulazione costituisce le strie lipidiche (tipo II). La morte delle cellule spumose (macrofago gonfio di goccioline di grasso, LDL) o per apoptosi o per necrosi, provoca il deposito di colesterolo nell'intima arteriale, prima in modo diffuso (tipo III), poi sotto forma di collezioni per costituire un corpo lipidico (tipo IV). L'infiammazione generata dagli Ox-LDL, così come dall'attivazione dei macrofagi, delle cellule endoteriali e delle cellule muscolari lisce che liberano delle citochine e/o dei fattori di crescita, permette alle cellule muscolari lisce della media di migrare verso l'intima, di moltiplicarsi e di sintetizzare una cappa di proteine fibrose che ricoprono il corpo lipidico. Questa placca aumenta allora significativamente di volume. Quando quest'ultimo super le capacità di rimodellamento della parete arteriale, la placca sporge dalla parete arteriale verso la luce del vaso dove realizza una stenosi (tipo V) (Duriez, 2004). I radicali liberi sono responsabili dell'ossidazione delle LDL plasmatiche in oxLDL aterogeno che fanno scattare una moltitudine di risposte infiammatorie e di reazioni biochimiche che portano al deposito di placche arteriose sulle pareti arteriali (fig. 31) (Sumpio e al., 2006). Le LDL plasmatiche non sono aterogene solo dopo modificazione ossidativa (Brown e Goldstein, 1983; Parthasarathy, 1991; Edwin, 2011). certi studi hanno dimostrato che lo stress ossidativo provoca l'apparizione dell'aterosclerosi
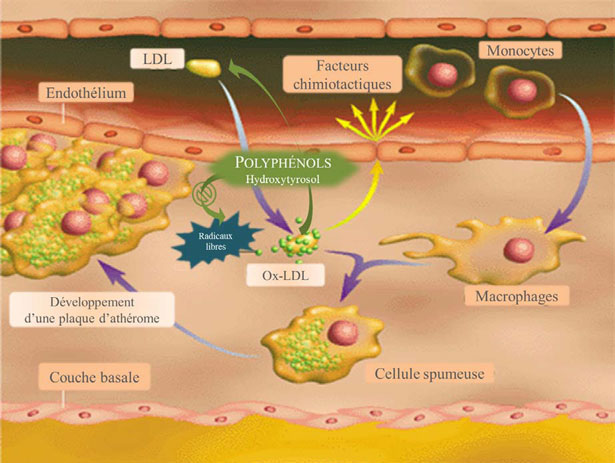
Figura 31. I composti fenolici impediscono l'ossidazione delle LDL che porta alla formazione di placche arteriose.
inducendo la perossidazione lipidica (Halliwell, 1997). Da questo punto di vista, gli antiossidanti che impediscono la perossidazione dei lipidi possono avere un ruolo importante nella prevenzione dell'ossidazione e la modificazione delle LDL.
Le LDL del plasma umano contengono una varietà di antiossidanti capaci di inibire la loro perossidazione, come l'α-tocoferolo, ubichinolo-10, β-carotene, il licopene e altri idrossi-carotenoidi. L'α-tocoferolo è l'antiossidante più abbondante nelle LDL (Princen e al. 1992; Abbey e al.1993; Reaven e al. 1993; Jialal e al. 1995; Hung e al., 2008); Tuttavia, è stato dimostrato che altri antiossidanti, esogeni, sono in grado di proteggere le LDL contro l'ossidazione (Cominacini e al. 1991; Esterbauer e al. 1992). Sulla base degli studi epidemiologici anteriori che sottolineano il legme diretto tra una dieta mediterranea e un'incidenza più bassa delle malattie cardiovascolari (Hertog e al. 1993 ; Ruiz-Canela., 2011), diversi studi relizzati in vitro e in vivo hanno dimostrato che i composti fenolici di olio d'oliva extra vergine giocano un ruolo importante nella prevenzione dell'ossidazione delle LDL portando all'aterosclerosi (Visioli e al. 1995a; Rice-Evans e al. 1996; Cao e al. 1997; Masella e al. 1999). In un campione di LDL, l'ossidazione della vitamina E indotta dal CuSO4 è stato impedito dall'addizione dell'Idrossitirosolo o dei composti secondari dell'oleuropeina; quest'effetto è stato correlato linearmente con la concentrazione di Idrossitirosolo. L'addizione di composti fenolici alle LDL comporta una riduzione significativa nella formazione di perossidi lipidici. In caso LDL non trattate dai composti fenolici, questi perossidi di lipidi sono formati nello stesso momento della riduzione del tasso di vitamina E. Quest'impoverimento in vitamina E delle LDL si produce prima della perossidazione lipidica massiccia. Ora, i composti fenolici ritardano l'inizio del processo d'ossidazione e preservano gli antiossidanti endogeni (Visioli e al. 1995a, 2000a). Certi studi sull'effetto antiossidante dei composti fenolici sulle LDL plasmatiche sono state effettuate, allo scopo di simulare il meglio possibile la situazione in vitro. Il plasma è stato incubato con diversi composti fenolici estratti dall'olio d'oliva; le LDL sono state poi isolate e sottomesse all'azione dei radicali liberi, al fine di testare la loro resistenza relativa all'ossidazione. I risultati hanno indicato che l'Idrossitirosolo e l'oleuropeina sono più efficaci contro la perossidazione delle LDL che i monoidrossifenoli (tirosolo e ligstroside aglicone), confermando i risultati anteriori di Rice-Evans (1996), Cao (1997) e dei loro collaboratori. Tuttavia, la concentrazione di antiossidanti aggiunta al plasma per inibire l'ossidazione delle LDL è stata sensibilmente più elevata che negli studi precedenti, dove gli antiossidanti sono stati aggiunti direttamente alle LDL isolate (Leenen e al., 2002). Questi dati confermano altri studi realizzati in vivo su degli animali nutriti con degli oli ricchi di polifenoli; in questi animali, le lipoproteine erano molto più resistenti all'ossidazione che gli animali campione nutriti con la stessa quantità di acido oleico (Scaccini e al., 1992), avendo cura di mantenere dei livelli costanti di vitamina E (Wiseman e al., 1996). Una concentrazione sanguigna elevata di colesterolo è un altro fattore di rischio dell'aterosclerosi. La regolazione del colesterolo plasmatico è legata all'attività dell'idrossimetilglutarilcoenzima A riduttasi (HMG-CoA réductase), l'enzima chiave nella biosintesi del colesterolo. L'utilizzazione di sostanze che inibiscono la HMG-CoA riduttasi è molto efficace nella riduzione del colesterolo nel sangue. Certi studi hanno attirato l'attenzione sull'effetto dei composti fenolici contenuti nell'olio d'oliva vergine sul metabolismo del colesterolo. Di recente, è stato dimostrato che l'attività dell'HMG-CoA riduttsi è significativamente diminuita nei microsomi del fegato di ratti nutriti con i composti fenolici. L'ingestione di olio d'oliva rappresenta un effetto benefico attraverso i composti fenolici che inibiscono la HMG-CoA riduttasi e giocano un ruolo importante nella prevenzione delle malattie cardiovascolari. Tuttavia, degli studi supplementari sono necessari al fine di testare la concentrazione di composti fenolici capaci di provocare tale risposta terapeutica (Benkhalti e al., 2002).
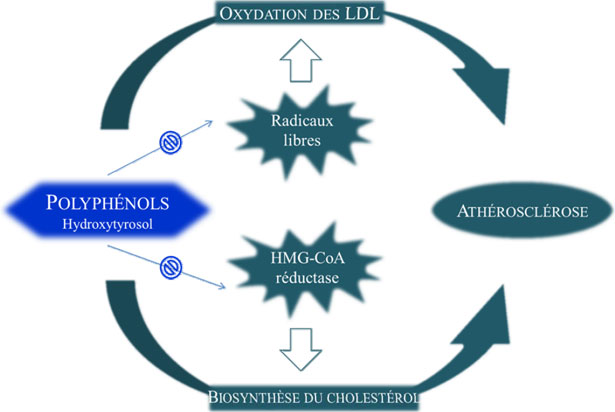
Figura 32. Effetti antiaterosclerosi dei polifenoli dell'olio d'oliva.
3. Effetto dei polifenoli dell'olio d'oliva contro l'aggregazione piastrinica
Uno studio in vitro ha esaminato l'effetto dell'Idrossitirosolo e de l'oleuropeina sull'aggregazione piastrinica. L'Idrossitirosolo inibisce completamente l'ADP (2 µM) e il collagene (2 µg/ml) inducendo l'aggregazione piastrinica nel plasma ricco di piastrine sanguigne (fig. 29) (Petroni e al., 1995). L'effetto antiaggregante dell'Idrossitirosolo è stato giudicato equivalente a quello dell'aspirina. Nello stesso studio, si è ugualmente rivelato che l'Idrossitirosolo è un inibitore della trombina inducendo della trombossano B2 (fig. 33) (implicata nell'attivazione e l'aggregazione piastrinica in caso di ferita). Nei volontari, è anche stato riportato che l'estratto di foglie d'oliva contenente 5.40 mg/ml di polifenoli, era capace di inibire l'attivazione delle piastrine in vitro in individui sani, non fumatori e di sesso maschile (Singh e al., 2007).
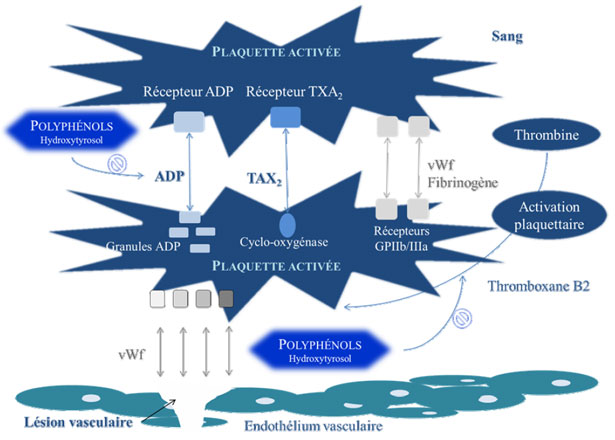
Figura 33. Effetto antiaggregazione piastrinica dei polifenoli dell'olio d'oliva.
Allo scopo di provare che l'AMPc e la GMPc fosfodiesterasi potrebbero essere il bersaglio biologico de l'inibizione dell'aggregazione piastrinica, Dell'Agli e i suoi colleghi (2007) hanno esaminato gli effetti degli estratti di olio di alto e basso tenore in polifenoli e dei composti fenolici semplici sull'aggregazione piastrinica. Gli estratti dell'olio e i fenoli semplici hanno presentato un effetto inibitore che dipende della concentrazione somministrata sull'aggregazione e sull'aggregazione e sull'AMPc fosfodiesterasi.
In una prova controllata randomizzata a Napoli, in Italia, 180 soggetti che soffrono di un disturbo metabolico sono stati invitati a seguire una dieta alimentare mediterranea con olio d'oliva. Dopo 2 anni, c'era un netto miglioramento della funzione endoteriale, con una diminuzione statisticamente significativa della pressione arteriosa, del colesterolo, dei livelli d'insulina e di glucosio e dell'aggregazione piastrinica. Ci sono state delle riduzioni sostanziali dei marcatori d'infiammazione vascolare sistemica, compresa la proteina C reattiva e l'interleuchina. Più di 66% dei soggetti hanno conosciuto delle riduzioni nei fattori di rischio, in modo tale che non sono più classificati come avendo una sindrome metabolica (Esposito e al., 2004). Ignoriamo ancora in quale via esattamente i polifenoli inibiscono l'aggregazione piastrinica. Ciò dovrebbe avvenire tramite una diminuzione della produzione d'eicosanoidi indotta dai composti fenolici o dalla degradazione dell'AMPc in collegamento con l'inibizione della cascata dell'acido arachidonico (Dell'Agli e al., 2007).
4. Effetto antinfiammatorio dei polifenoli dell'olio d'oliva
La risposta infiammatoria nel corso dell'aterogenesi comprende l'adesione dei leucociti, dei monociti e dei linfociti all'endotelium. L'adesione di queste cellule è facilitata dalle molecole di aderenza intercellulare 1 (ICAM-1), le molecole di adesione cellulare vascolare-1 (VCAM-1) e il fattore E-selezione (Dell'Agli e al., 2006). Carluccio e al (2003) hanno riportato che delle dosi fisiologicamente pertinenti di composti fenolici estratti dall'olio d'oliva extra vergine riducono l'espressione degli ICAM-1 e dei VCAM-1 sulla superficie delle cellule (fig. 34). Una miscela di polifenoli di olio d'oliva, compresa l'oleuropeina, l'Idrossitirosolo e il tirosolo ha anche provocato una diminuzione dei livelli di ARNm di VCAM-1, del fattore E-selezione e l'attività del promotore del gene codificando per l'ICAM-1 (Carluccio e al., 2003). Lo studio PREDIMED su dei soggetti umani ha constatato che la dieta mediterranea con olio d'oliva ha portato una progressione statisticamente significativa della riduzione dei marcatori dell'infiammazione la cui proteina C-reattiva (sintetizzata dal fegato), l'interleuchina-6, ICAM-1 e VCAM-1 rispetto a una dieta povera di grassi (Estruch e al., 2003).
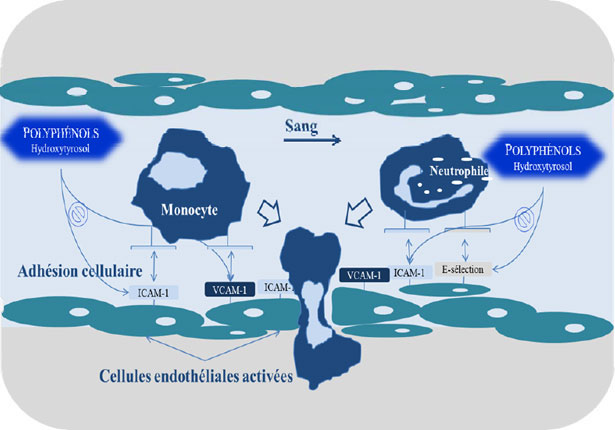
Figura 34. Effetto dei polifenoli sulle molecole di adesione endoteliali.
Infine, poche ricerche hanno esaminato l'effetto della dieta mediterranea sulla parete vascolare. Lo studio PREDIMED ha esaminato l'effetto dell'olio d'oliva sui cambiamenti morfologici della parete vascolare. Le misure degli spessori intima-media della carotide (EIM) sono state utilizzate come marcatori di sostituzione per valutare la gravità della malattia d'aterosclerosi. Un aumento di 0,2 mm nell'EIM è stato implicato in 28% e 31% d'aumento del rischio d'infarto del miocardio e di accidente vascolare cerebrale, rispettivamente (de Groot e al., 2004). I dati raccolti su 190 partecipanti hanno constatato che quelli che hanno consumato meno olio d'oliva sono i più esposti all'aumento dell'EIM. Un altro studio ha rivelato una differenza statisticamente significativa tra lo spessore dell'EIM di quelli che hanno consumato da 6 a 34 g paragonato a quelli che ne hanno mangiato 35 a 74g di olio al giorno (Buil-Cosiales., 2008).
5. L'Idrossitirosolo dell'olio d'oliva aumenta il tasso del monossido di azoto, gas vasodilatatore
In caso d'ipercolesterolemia, la produzione di anioni superossidi e altre specie di radicali liberi ha aumentato nelle cellule endoteliali, le cellule muscolari lisce, e i monociti rispetto a quelle di controllo normocolesterolemiche (Keaney e Vita, 1995). Queste specie reagiscono con il monossido di azoto (NO) e degradano l'endotelium vascolare che allora non può produrre abbastanza NO, il che può portare all'aggregazione piastrinica fino alla trombosi. La diminuzione della bioattività del NO può provocare una costrizione delle arterie coronariche nel corso dell'esercizio fisico e l'infiammazione vascolare che conduce alla formazione di cellule schiumose (Cannon, 1998). Dall'altro, degli studi hanno dimostrato che gli oxLDL stimolano la trascrizione della NO sintasi e la sintesi di NO nelle cellule aortiche bovine (Hirata e al., 1995). Altri studi hanno anche dimostrato un'espressione maggiore della NO sintasi nei tessuti aortici del conoglio affetto d'aterosclerosi e nelle placche arteriose nell'Uomo. Questa sovrapproduzione accompagna l'inattivazione ossidativa o la conversione rapida di NO in ONOO- tossico in ragione dell'accumulo di anioni superossidi e altri radicali liberi (Cannon, 1998). Degli studi suggeriscono che la disfunzione vascolare può essere limitata grazie all'apporto degli agenti capaci d'intrappolare questi radicali liberi (Perona e al., 2006). Il consumo di un pasto ricco di composti fenolici dell'olio d'oliva ha migliorato la vasodilatazione microvascolare endotelium-dipendente durante le prime 4 ore del periodo postprandiale nei volontari ipercolesterolemici. Dei soggetti alimentati con un pasto ricco di polifenoli hanno mostrato una più forte concentrazione di NO e dei livelli inferiori di lipoperossido (lipidi perossidati) rispetto a quelli nutriti con un pasto povero di polifenoli. Questo miglioramento è legato a una diminuzione dello stress ossidativo e un aumento nei prodotti finali di NO (Ruano e al., 2005). Inoltre, l'oleuropeina stimola la produzione del NO nei macrofagi del topo e attiva la forma inducibile della NO sintasi (Visioli e al., 1998). Un'inchiesta su 20343 soggetti, nell'ambito della coorte greca dell'EPIC (Prospettiva Europea dello Studio del Cancro e la Nutrizione) ha constatato che l'adesione alla dieta mediterranea è inversamente proporzionale all'incidenza della pressione arteriosa sistolica e diastolica. L'olio d'oliva, la frutta e la verdura sono stati i principali fattori responsabili dell''effetto globale della dieta mediterranea sulla pressione arteriosa. Ora, i cereali, generalmente considerati come benefici per la salute umana, sono stati correlati a un aumento della pressione arteriosa (Psaltopoulou e al., 2004).
VIII. La protezione dei polifenoli contro le lesioni delle proteine
Diversi studi hanno dimostrato che le onde lunghe ultraviolette (UVA) dell'irraggiamento inducono delle lesioni gravi della pelle attraverso la generazione dei ROS e l'esaurimento dei sistemi antiossidanti endogeni. D'Angelo e i suoi collaboratori (2001) hanno notato un aumento notevole dei prodotti di perossidazione dei lipidi e del residuo L-isoaspartyl anormale (marcatore dell'ossidazione delle proteine) nelle cellule di melanoma umano irradiate dagli UVA. In questo studio, l'effetto dell'Idrossitirosolo, sui danni cellulari indotti dagli UVA è stato studiato, utilizzando una linea cellulare di melanoma umano (cellule M14) come sistema modello. Nelle cellule M14 irradiate dagli UVA, l'idrossitirosolo esercita un effetto protettore tradotto dall'ascensione dei marcatori tipici di stress ossidativo, come i TBARS (marcatori di ossidazione dei lipidi). Inoltre, l'Idrossitirosolo impedisce l'aumento dei residui di L-isoaspartate modificati formati dopo l'irradiazione delle proteine con gli UVA. Questi effetti protettivi sono dosa-dipendenti, con un massimo raggiunto a una concentrazione di 400 mM d'Idrossitirosolo. Questi risultati sono in linea con l'ipotesi che lo stress ossidativo gioca un ruolo maggiore nella mediazione dei danni proteici indotti dagli UVA. I risultati suggeriscono che l'Idrossitirosolo esercita degli effetti diversi selle cellule di melanoma in funzione della dose utilizzata e questo deve sempre essere preso in conto quando si consuma l'olio e i suoi prodotti derivati, compresi i prodotti cosmetici e gli alimenti funzionali.
IX. Effetto antimicrobico dei polifenoli dell'olio d'oliva
Diversi studi hanno dimostrato la capacità dell'Idrossitirosolo a ritardare o impedire la crescita di una gamma di batteri e funghi, compresi i batteri patogeni per l'Uomo (agenti patogeni umani). È stato riportato che l'acqua di vegetazione che risulta dell'estrazione dell'olio d'oliva è tossico per i batteri fitopatogeni Pseudomonas syringae (Gram-negativo) e Corinebatteri michiganense (Gram-positivo). Capasso e i suoi colleghi (1995) hanno segnalato che tr i principali polifenoli dell'acqua di vegetazione, il metilcatecolo ha mostrato una forte attività battericida contro P. syringae, mentre contro C. michiganense è stato solo leggermente attivo. Altri polifenoli, come il cateolo e l'Idrossitirosolo, sono stati meno attivi sui ceppi di P. syringae, e inattivi sul C. michiganense. Bisignano e al. (1999) hanno studiato la sensibilità in vitro di diversi agenti patogeni delle vie respiratorie o intestinali dell'Uomo all'Idrossitirosolo e all'oleuropeina. Gli agenti patogeni studiati erano, cinque ceppi batterici standard (Haemophilus influenzae ATCC 9006; Moraxella catarrhalis ATCC 8176; Salmonella typhi ATCC 6539; Vibrio parahaemolyticus ATCC 17802 e Staphylococcus aureus ATCC 25923) e 44 isolati freschi (isolato a partire da soggetti ospedalizzati) (Haemophilus influenzae, otto ceppi; Moraxella catarrhalis, sei ceppi; Salmonella typhi, 15 ceppi; Vibrio cholerae, un ceppo; Vibrio alginolyticus, due ceppi; Vibrio parahaemolyticus, un ceppo; Staphylococcus aureus; cinque sensibili alla penicillina e sei ceppi resistenti alla penicillina). La concentrazione minima inibitrice (CMI) segnalata in questo studio ha provato una larga attività antimicrobica di Idrossitirosolo contro questi ceppi batterici (CMI tra 0,24 e 7,85 mg/ml per i ceppi standard e tra 0,97 e 31,25 mg/ml per i ceppi isolati clinicamente). Questi risultati suggeriscono che l'Idrossitirosolo può essere utile nel trattamento antimicrobico delle infezioni respiratorie nell'Uomo.
X. Prevenzione dei polifenoli dell'olio d'oliva contro il diabete
Il diabete di tipo 1 è una malattia metabolica provocata da un'insufficienza completa o relativa della secrezione d'insulina (Henquin et al., 1992). È l'una delle principali cause di numerose complicazioni legate a numerose malattie. L'aumento cronico della glicemia finirà col causare delle lesioni tessutali, una malattia che ha spesso gravi conseguenze. I danni tessutali possono essere osservati in numerosi organi e sistemi (Henquin e al., 1992 ; Hamden e al., 2008). L'iperglicemia porta a complicazioni a lungo termine che sono le principali cause di morbilità e mortalità nelle popolazioni umane (Palsamy e al., 2009). L'aumento della produzione di radicali liberi così come lo stress ossidativo sembra giocare un ruolo importante nella patogenesi del diabete e le sue complicazioni tardive (Palsamy e al., 2009). Hamden e i suoi collaboratori (2009) hanno studiato l'effetto dell'Idrossitirosolo e altri composti fenolici sullo stress ossidativo e l'iperglicemia indotta nei ratti con l'alloxana (C4H2N2O4). Questo studio dimostra per la prima volta che i polifenoli e le acque di vegetazione delle olive (ricche in Idrossitirosolo) sono efficaci per l'inibizione dello stress ossidativo e l'iperglicemia indotti dal diabete. Questo studio suggerisce quindi che l'amministrazione dei polifenoli dell'olio d'oliva può essere utile nella prevenzione delle complicazioni diabetiche associate allo stress ossidativo.
XI. Prevenzione dei polifenoli contro la malattia d'Alzheimer
Gli studi epidemiologici indicano che il consumo di olio d'oliva può ritardare il declino cognitivo (Solfrizzi e al., 1999, 2003, 2005, 2006; Panza e al., 2004). Le proteine Tau (isoforme Tau) fanno parte della famiglia delle proteine associate ai microtubuli che sono principalmente espressi nei neuroni del sistema nervoso centrale. Favoriscono l'assemblaggio della tubulina in microtubuli monomeri e di modulare la loro stabilità, giocando così un ruolo strutturale chiave nella parte distale degli assoni. Nella malattia di Alzheimer e altre malattie neurodegenerative, quando la proteina Tau è iperfosforilata, si distacca di microtubuli, e si conforma in paia di filamenti elicoidali patologici, che si aggregano in ammassi di neurofibrilli causando una neuro degenerazione fibrillare progressiva. Le sostanze necessarie al funzionamento del neurone non potendo più essere incanalate fino al corpo cellulare, portano al decesso del neurone. Daccache e i suoi colleghi (2011) hanno studiato la capacità dei tre composti fenolici naturali ottenuti a partire dell'olio d'oliva; sapendo che l'Idrossitirosolo, l'oleuropeina, e l'oleuropeina aglicone prevengono l'aggregazione delle proteine Tau in matasse fibrillari in vitro. I principali costituenti fenolici dei frutti d'olive o di olio d'oliva, oleuropeina, aglicone oleuropeina e l'Idrossitirosolo, inibiscono l'aggregazione delle proteine Tau allo stesso livello del blu di metilene (principio attivo di referenza). Idrossitirosolo, uno dei principali metaboliti dell'oleuropeina, raggiunge il cervello dopo consumo di olio d'oliva. I risultati mostrano che questo metabolita agisce in quanto polifenolo che inibisce l'aggregazione di proteine Tau in un modo simile ad altri composti fenolici (fig. 35). La presenza di frammenti di aldeide nelle forme tautomere dell'oleuropeina aglicone aumenta la capacità d'inibizione di quest'ultimo, con un meccanismo che può differire da quello degli oleocantal, un altro composto dialdeico isolato dall'olio d'oliva.
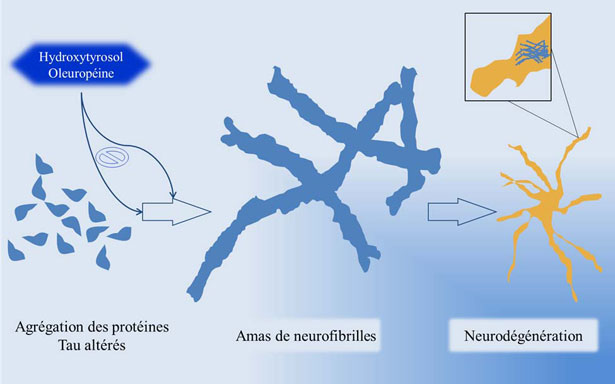
Figura 35. Effetto dei polifenoli dell'olio d'oliva sulla malattia d'Alzheimer.
Alla luce di questi risultati, la capacità dell'oleuropeina aglicone, dell'oleuropeina e dell'Idrossitirosolo a inibire l'aggregazione Tau. Questi composti possono così essere legati alla riduzione del rischio della malattia d'Alzheimer o le demenze neurodegenerative associate con la dieta mediterranea e il consumo di olio d'oliva e fornisce una base chimica per lo sviluppo degli inibitori dell'aggregazione di proteine Tau.
Referenze bibliografiche e opere scientifiche
Abbey M, Nestel PJ & Baghurst PA (1993). Antioxidant vitamins and low density lipoprotein oxidation. American Journal of Clinical Nutrition. 58, 52.
Aeschbach R, Loliger J, Scott BC, Murcia A, Butler J, Halliwell B, Aurome OI (1994). Antioxidant actions of tymol, carvacrol, 6-gingerolo, zingerone and hydroxytyrosol. Food and Chemical Toxicology. 32: 31–36.
Amanda L, Clark, Kathryn Mansfield Matera (2010). Effect of unsaturation in fatty acids on the binding and oxidation by myeloperoxidase: Ramifications for the initiation of atherosclerosis. Bioorganic & Medicinal Chemistry Letters. 20: 5643–5648.
Andrikopoulos N, Hassapidou M, Manoukas A (1989). The Tocopherol Content of Greek Olive Oils. J. Sci. Food Agric. 46: 503-509.
Anon (1983). Presencia Historica del Aceite de Oliva, in (Cabrera,F.B,ed), Las Raices del Aceite de Oliva, Ministerio de Agricultura , Servicio de Publicaciones Agrarias, Madrid.
Aparicio R., Luna G (2002). Characterization of Monovarietal Virgin Olive Oils. Eur. J. Lipid Sci. Tech- nol. 104: 614-627.
Aruoma OI (1994). Nutrition and health aspects of free radicals and antioxidants. Food and Chemical Toxicology. 32: 671–683.
Aruoma OI, Deiana M, Jenner A, Halliwell B, Harparkash K, Banni S, Corongiu FF, Dessi MA, Aeschbach R (1998). Effect of hydroxytyrosol found in extravirgin olive oil on DNA damage and on low-density lipoprotein oxidation. Journal of Agricultural and Food Chemistry. 46: 5181–5187.
Baccouri O, Guerfel M, Baccouri B, Cerretani L, Bendini A, Lercker G, Zarrouk M, Daoud Ben Miled D (2008). Chemical composition and oxidative stability of Tunisian monovarietalvirgin olive oils with regard to fruit ripening. Food Chemistry. 109: 743–754.
Bai, C, Yan X, Takenakay M, Sekiya, S, Nagata, T. (1998). Determination of synthetic hydroxytyrosol in rat plasma by GC– MS. Journal of Agricultural and Food Chemistry. 46: 3998–4001.
Beauchamp G, Keast R, Morel D (2005). Ibuprofen-like Activity in Extra Virgin Olive Oil. Nature. 437: 45-46.
Belitz HD, Grosch W, Schieberle P (2004). Food Chemistry (3rd edition). Berlin: Springer Verlag.
Belkner J, Wiesner R, Rathman J, (1993). Oxygenation of Lipoproteins by Mammalian Lipoxygenases. Eur J Biochem. 213: 251-261,
Beltran G, Aguilera A, del Rio C, (2005). Influence of Fruit Ripening Process on the Natural Antioxidant Content of Hojiblanca Virgin Olive Oils. Food Chem. 89: 207-215,
Ben Sassi A, Boularbah A, Jaouad A, Walker G, Boussaid A (2006). A comparison of Olive oil Mill Wastewaters (OMW) from three different processes in Morocco. Process Biochemistry. 41 (1): 74–78.
Bendini A, Cerretani L, Carrasco-Pancorbo A, Maria Gómez-Caravaca A, Segura-Carretero A, Fernández-Gutiérrez A and G Lercker (2007). Phenolic Molecules in Virgin Olive Oils: a Survey of Their Sensory Properties, Health Effects, Antioxidant Activity and Analytical Methods. An Overview of the Last Decade. Molecules. 12: 1679-1719.
Benkhalti F, Prost J, Paz E, Perez-Jimenez F, El Modafar C, El Boustani E (2002). Effects of feeding virgin olive oil or their polyphenols on lipid of rat liver. Nutrition Research. 22: 1067–1075.
Bianco A, Chiacchio M, Grassi D (2006). Phenolic Components of Olea europaea: Isolation of New Tyrosol and Hydroxytyrosol Derivatives. Food Chem. 95: 562-565.
Bianco A, Coccioli F, Guiso M (2001). Presence in Olive Oil of a New Class of Phenolic Compounds: Hydroxyl-isochromans. Food Chem. 77: 405-411.
Bisignano G, Tomaino A, Lo Cascio R, Crisafi G, Uccella N, Saija A (1999). On the in-vitro antimicrobial activity of oleuropein and hydroxytyrosol. Journal of Pharmacy and Pharmacology. 51: 971–974.
Blazquez-Martinez JM (1996). History of Olive Tree, The World Olive Encyclopaedia, IOOC. Madrid, pp19-54.
Blekas G, Psomiadou E, Tsimidou M (2002). On the Importance of Total Polar Phenols to Monitor the Stability of Greek Virgin Olive Oil. Eur. J. Lipid Sci. Technol. 104: 340-346.
Bonanome A, Pagnan A, Biffanti S (1992). Effect of Dietary Monounsaturated and Polyunsaturated Fatty Acids on the Susceptibility of Plasma Low Density Lipoproteins to Oxidative Modification. Arterioscler Thromb. 12: 529-533.
Bonanome A, Pagnan A, Caruso D, Toia A, Xamin A, Fedeli E, Berra B, Zamburlini A, Ursini F, Galli G, (2000). Evidence of postprandial absorption of olive oil phenols in humans. Nutrition, Metabolism and Cardiovascular Diseases. 10: 111–120.
Boskou D (1996). Olive oil: Chemistry and Technology. AOCS Press, Champaign. IL: 52– 83.
Boskou D, In. Gunstone F (ed) (2002). Vegetable Oils in Food Technology. Oxford: CRC Press. 244-277.
Brenes M., Hidalgo F, Garcia A, (2000). Pinoresinol and 1-acetoxypinoresinol, Two New Phenolic Compounds Identified in Olive Oil. JAOCS. 77:715-720,
Brown MS, Goldstein JL (1983). Lipoprotein metabolism in the macrophage: implications for cholesterol deposition in atherosclerosis. Annual Review of Biochemistry. 52: 223.
Buil-Cosiales P, Irimia P, Berrade N, (2008). Carotid intima-media thickness is inversely associated with olive oil consumption. Atherosclerosis. 196:742–748.
Cannon R (1998). Role of nitric oxide in cardiovascular disease: focus on the endothelium. Clin Chem. 44:1809–1819.
Cantarelli C (1961). Sui polifenoli presenti nella drupa e nell'olio di oliva. Riv. Ital. Sost. Grasse. 38: 69–72.
Cao G, Sofic E, Prior RL (1997). Antioxidant and prooxidant behavior of flavonoids: structure-activity relationships. Free Radical Biology and Medicine. 22: 749–760.
Capasso R, Evidente A, Schivo L, Orru G, Marcialis MA, Cristinzio G (1995). Antibacterial polyphenols from olive oil mill waste waters. Journal of Applied Bacteriology. 79: 393–398.
Carluccio M, Siculella L, Ancora M, (2003). Olive oil and re d wine antioxidant polyphenols inhibit endothelial activation: antiatherogenic proper ties of Mediterranean diet phytochemicals. Ar terioscler Thromb Vasc Biol. 23:622–629.
Carrasco-Pancorbo A, Cerretani L, Bendini A, Segura-Carretero A, Gallina- Toschi T, Fernndez-Gutirrez A (2005). Analytical determination of polyphenols in olive oils. J. Sep. Sci. 28: 837 – 858
Caruso D, Visioli F, Patelli R., Galli C, Galli G (2001). Urinary excretion of olive oil phenols and their metabolites in humans. Metabolism. 50: 1426–1428.
Cohen J (2002). Therapies. Confronting the limits of success. Science; 296:2320–2324.
Cominacini L, Garbin U, Cenci B, Davoli A (1991). Predisposition to LDL oxidation during copper-catalyzed oxidative modification and its relation to a-tocopherol content in humans. Clinica Chimica Acta. 204: 57–68.
Covas MI, Konstantinidou V, Fito M (2009). Olive oil and cardiovascular health. J Cardiovasc Pharmacol. 54: 477–82.
D'Angelo S, Manna C, Migliardi V, Mazzoni O, Morrica P, Capasso G, Pontoni G, Galletti P, Zappia V (2001). Pharmacokinetics and metabolism of hydroxytyrosol, a natural antioxidant from olive oil. Drug Metabolism and Disposition. 29: 1492–1498.
Daccache A, Lion C, Sibille N, Gerard M, Slomianny C, Lippens G, Cotelle P (2011). Oleuropein and derivatives from olives as Tau aggregation inhibitors. Neurochemistry International.
de Groot E, Hovingh G, Wiegman A, (2004). Measurement of ar terial wall thickness as a surrogate marker for atherosclerosis. Circulation. 109: III33–III38.
De Leonardis A, Macciola V, De Felice M (1998). Rapid Determination of Squalene in Virgin Olive Oils Using Gas-liquid Chromatography. It. J. Food Sci. 1: 75-80.
de Rojas-Walker T, Tamir S, Ji H, Wishnock J, Tennanbaum SR (1995). Nitric oxide induces oxidative damage in addition to deamination in macrophages DNA. Chemical Research in Toxicology. 8: 473–477.
Deiana M, Aruoma OI, Bianchi MDLP, Spencer JPE, Kaur H, Halliwell B, Aeschbach R, Banni S, Dessi MA, Corongiu FP (1999). Inhibition of peroxynitrite dependent DNA base modification and tyrosine nitration by the extra virgin olive oil-derived antioxidant hydroxytyrosol. Free Radical Biology and Medicine. 26: 762–769.
Dell'Agli M, Fagnani R, Mitro N (2006). Minor components of olive oil modulate proatherogenic adhesion molecules involved in endothelial activation. J Agric Food Chem. 54: 3259–3264.
Dell'Agli M, Maschi O, Galli G (2007). Inhibition of platelet aggregation by olive oil phenols via cAMP phosphodiesterase. Br J Nutr. 11:1–7.
Di Giovacchino L (1989). Olive Processing Systems. Separation of the Oil from the Must. Olivae. 26: 21-29.
Di Giovacchino L (1996). Influence of Extraction Systems on Olive Oil Quality, in (Boskou D., ed), Olive Oil, Chemistry and Technology. AOCS Press, Champaign, Illinois. 12-51.
Di Giovacchino L, Sestili S, Di Vincenzo D (2002). Influence of olive processing on virgin olive oil quality. Eur. J. Lipid Sci. Technol. 104: 587–601
Dougherty RM, Galli C, Ferro-Luzzi A (1987). Lipid and Phospholipid Fatty Acid Composition of Plasma, Red Blood Cells, and Platelets and How They are Affected by Dietary Lipids: a Study of Normal Subjects From Italy, Finland, and the USA. Am J Clin Nutr. 45: 443-455,
DT Angelo S, Ingrosso D, Perfetto B, Baroni A, Zappia M, Lo bianco Lubrano L, Tufano MA, Galletti P (2001). UVA irradiation induces l-isoaspartyl formation in melanoma cell proteins. Free Radic. Biol. Med. 31:1– 9.
Duriez P (2004). Mécanismes de formation de la plaque d'athérome. La revue de médecine interne 25 : S3–S6.
Edwin N. Frankel (2011). Nutritional and biological properties of extra virgin olive oil. J. Agric. Food Chem.
Esposito K, Marfella R, Ciotola M, (2004). Effect of a Mediterranean style diet on endothelial dysfunction and markers of vascular inflammation in the metabolic syndrome: a randomized trial. JAMA. 292:1440–1446.
Esterbauer H, Gebicki J, Puhl H, Jurgens G (1992). The role of lipid peroxidation and antioxidants in oxidative modification of LDL. Free Radical Biology and Medicine. 13: 341.
Estruch R, Mar tinez-Gonzalez M, Corella D (2006). Effects of a Mediterranean-style diet on cardiovascular risk factors. Ann Int Med. 145:1–11.
Evagelia T, Harris N. Lazarides and Konstantinos B (2004). Olive Mill Wastewater Treatment. Petrotos Aristotle University of Thessaloniki, Department of Food Science and Technology, 54006, Thessaloniki, Greece.
Finotti E, Di Majo D (2003). Influence of solvents on the antioxidant property of flavonoids. Nahrung/Food. 47: 186–187.
Gandul-Rojas B, Mínguez-Mosquera M (1996). Chlorophyll and Carotenoid Composition in Virgin Olive Oils From Various Spanish Olive Varieties, J. Sci. Food Agric. 72: 31-39.
Gardner CD, Kraemer HC (1995). Monounsaturated Versus Polyunsaturated Dietary Fat and Serum Lipids. A Meta-analysis. Arterioscler Thromb Vasc Biol. 15: 1917-1927.
Grams G, Eskins K (1972). Dye-sensitized Photoxidation of Tocopherols: Correlation Between Singlet Oxygen Reactivity and Vitamin E Activity. Biochemistry. 11: 606-608.
Granados-Principal SP, Quiles LJ, Ramirez-Tortosa CL, Sanchez-Rovira P, and Ramirez-Tortosa MC (2010). Hydroxytyrosol: from laboratory investigations to future clinical trials. Nutrition Reviews.68(4):191–206.
Gunstone F, Harwood J, Padley F (eds) (1994). The Lipid Handbook (2nd Edition). London: Chapman and Hall.
Gunstone FD (2004). The Chemistry of Oils and Fats Sources, Composition, Properties and Uses. Oxford, UK: Blackwell Publishing.
Gutfinger T (1981). Polyphenols in Olive Oils. JAOCS. 58: 966-968.
Gutteridge JM, Halliwell B (1992). Comments on review of Free Radicals in Biology and Medicine, second edition, by Barry Halliwell and John M. C. Gutteridge. Free Radic Biol Med. 12: 93-95.
Haiwell B, Gutteridge JMC (1999). "Free Radicals in Biology and Medicine." Oxford University Press, Oxford.
Halliwell B (1997). Antioxidants and human disease: a general introduction. Nutrition Reviews. 55, 44–52.
Halliwell B, Aeschbach R, Loliger J, Aruoma OI (1995). The characterization of antioxidants. Food and Chemical Toxicology. 33: 601–617.
Halliwell B, Gutterige MC (1990). Role of free radicals and catalytic metal ions in human disease: an overview. Methods in Enzymology. 186: 1–85.
Hamden K, Carreau S, Lajmi S, Aloulou D, kchaou D, Elfeki A (2008). Protective effect of 1,7-estradiol on hyperglycemia, stress oxidant, liver dysfunction and histological changes induced by alloxan in male rat pancreas and liver. Steroids. 94: 495–501.
Hamdi K, Hamdi, Castellon R (2005). Oleuropein, a non-toxic olive iridoid, is an anti-tumor agent and cytoskeleton disruptor. Biochemical and Biophysical Research Communications. 334: 769 778.
Hammer SM (2005). Clinical practice. Management of newly diagnosed HIV infection. N Engl J Med; 353: 1702–1710.
Han J, Talorete TP, Yamada P, Isoda H (2009). Anti-proliferative and apoptotic effects of oleuropein and hydroxytyrosol on human breast cancer MCF-7 cells. Cytotechnology. 59:45–53.
Hao J, Shen W, Yu G, Jia H, Li X, Feng Z, Wang Y, Weber P, Wertz K, Sharman E, Liu J (2010). Hydroxytyrosol promotes mitochondrial biogenesis and mitochondrial function in 3T3-L1 adipocytes. Journal of Nutritional Biochemistry. 21: 634–644.
Harborne JB, Dey PM.. Methods in Plant Biochemistry. Harborne JB (Ed.) (1989). AcademicPress, London (UK).
Hegsted DM., Ausman LM, Johnson JA (1993). Dietary Fat and Serum Lipids: an Evaluation of the Experimental Data. Am J Clin Nutr. 57: 875-883.
Henquin C, Debuyser A, Drews G (1992). Plant, Regulation of K+ permeability and membrane potential in insulin-secretory cells, in: P.R. Flatt (Ed.), Nutrient Regulation of Insulin Secretion, Porland, London. pp. 173–192.
Hertog MLG, Feskens EJM, Katan MB, Kromhout D (1993). Dietary antioxidant flavonoids and risk of coronary heart disease: the Zutphen Elderly Study. Lancet. 342: 1007.
Hrncirik K, Fritsche S (2004). Comparability and Reliability of Different Techniques for the Determination of Phenolic Compounds in Virgin Olive Oil. Eur. J. Lipid Sci. Technol. 106: 540-549.
Huang CL, Sumpio BE (2008). Olive oil, the Mediterranean diet, and cardiovascular health. J Am Coll Surg. 207:407–16.
Huang MT, Osawa T, Ho CT, Rosen RT (1994). Food phytochemicals for cancer prevention. In Fruits and Vegetables. ACS Symposium Series no. 46. Washington, DC: American Chemical Society.
Jialal I, Fuller CJ, Huet BA (1995). The effect of α-tocopherol supplementation on LDL oxidation. A dose-response study. Arteriosclerosis, Thrombosis, and Vascular Biology. 15: 190–198.
Johnson IT, Williamson G, Musk SRR (1994). Anticarcinogenic factors in plant foods. A new class of nutrients. Nutrition Research Reviews. 7: 1–30.
Katan MB (1995). Fish and Heart Disease. N Engl J Med. 332: 1024-1025,.
Katiyar S, Mukhtar H (1996). Tea in the chemoprevention of cancer: epidemiologic and experimental studies. In t J Oncol. 8: 221–238.
Keceli T, Gordon MH (2001). The antioxidant activity and stability of the phenolic fraction of green olives and extra virgin olive oil. Journal of the Science of Food and Agriculture. 81: 1391–1396.
Lanzón A, Albi T, Cert A (1994). The Hydrocarbon Fraction of Virgin Olive Oil and Changes Resulting From Refining. JAOCS. 71: 285-291,
Lavee S (1996). Olive Tree Biology and Physiology, World Olive Encyclopaedia, IOOC, Madrid, pp5910,.
Lee-Huang S, Lin Huang P, Zhang D, Wook Lee J, Bao J, Sun Y, Chang YT, Zhang J, Lee-Huang P (2007). Discovery of Small-Molecule HIV-1 Fusion and Integrase Inhibitors Oleuropein and Hydroxytyrosol: I. Fusion Inhibition. Biochem Biophys Res Commun. 23; 354(4): 872–878.
Lee-Huang S, Zhang L, Huang PL, Chang YT (2003). Anti-HIV activity of olive leaf extract (OLE) and modulation of host cell gene expression by HIV-1 infection and OLE treatment. Biochem Biophys Res Commun; 307:1029–1037.
Leenen R, Roodenburg AJ, Vissers MN, Schuurbiers JA, van Putte KP, Wiseman SA , van de Put FH (2002). Supplementation of plasma with olive oil phenols and extracts: influence on LDL oxidation. Journal of Agricultural and Food Chemistry. 50: 1290–1297.
Loukas M, Krimbas CB (1983). History of Olive Cultivars Based on the Generic Distances, J.Hort. Science. 58: 121-127.
Manna C, Galletti P, Cucciolla V, Moltedo O, Leone A, Zappia V (1997). The protective effect of the olive oil polyphenol (3,4-dihydroxyphenyl) ethanol counteracts reactive oxygen metabolite-induced cytotoxicity in Caco-2 cells. Journal of Nutrition. 127: 286–292.
Manna C, Galletti P, Cucciolla V, Montedoro GF, Zappia V (1999). Olive oil hydroxytirosol protects human erythrocytes against oxidative damages. Journal of Nutritional Biochemistry. 10: 159–165.
Manna C, Galletti P, Maisto G, Cucciolla V, Dangelo S, Zappia V (2000). Transport mechanism and metabolism of olive oil hydroxytyrosol in Caco-2 cells. FEBS Letters. 470: 341–344.
Manzi P, Panfili G, Esti M, (1998). Natural Antioxidants in the Unsaponifiable Fraction of Virgin Olive Oils From Different Cultivars. J. Sci. Food Agric. 77: 115-120.
Martin S, Andriantsitohaina R (2002). Cellular mechanism of vasculo-protection induced by polyphenols on the endothelium. Annales de cardiologie et d'angéiologie. 51: 304–315.
Masella R, Cantafora A, Modesti D, Cardilli A, Gennnaro L, Bocca A, Coni E (1999). Antioxidant activity of 3, 4-DHPEA-EA and protocatechuic acid: a comparative assessment with other olive oil biophenols. Redox Report. 4: 113–121.
Mateos R, Espartero J, Trujillo M (2001). Determination of Phenols, Flavones and Lignans in Virgin Olive Oil by Solid Phase Extraction and HPLC With Diode Array Ultraviolet Detection. J Agric. Food Chem. 49: 2185-2192.
Menotti A, Blackburn H, Kromhout (1997). Changes in population cholesterol levels and coronar y hear t disease deaths in seven countries. Eur Heart J.18: 566–571.
Mensink RP, Zock PL, Kester AD (2003). Effects of Dietary Fatty Acids and Carbohydrates on the Ratio of Serum Total to HDL Cholesterol and on Serum Lipids and Apolipoproteins: a Meta-analysis of 60 Controlled Trials. Am J Clin Nutr. 77: 1146-1155,
Mínguez-Mosquera M, Rejano-Navarro L, Gandul-Rojas B (1991). Color-pigment Correlation in Virgin Olive Oil. JAOCS. 68: 332-336,
Mínguez-Mosquera M., Gandul-Rojas B, Garrido-Fernández (1990). J Pigments Present in Virgin Olive Oil. JAOCS. 67: 192-196,
Miro-Casas E, Covas MI, Farre M, Fito M, Ortuno J, Weinbrenner T, Roset P, de la Torre R, (2003a). Hydroxytyrosol disposition in humans. Clinical Chemistry. 49: 945–952.
Miro-Casas E, Covas MI, Fito M, Farre-Albadalejo M, Marrugat J, de la Torre R (2003b). Tyrosol and hydroxytyrosol are absorbed from moderate and sustained doses of virgin olive oil in humans. European Journal of Clinical Nutrition. 57 : 186–190.
Miro-Casas E, Farre Albaladejo M, Covas MI, Rodriguez JO, Menoyo Colomer E, Lamuela Raventos RM, de la Torre R (2001). Capillary gas chromatography-mass spectrometry quantitative determination of hydroxytyrosol and tyrosol in human urine after olive oil intake. Analytical Biochemistry. 294: 63–72.
Montedoro GF, Cantarelli C (1969). Indagine sulle sostanze fenoliche presenti nell'olio di oliva. Riv. Ital. Sost. Grasse. 46: 115–124.
Montedoro GF, Garofolo L, Bertuccioli M (1986). Factors Shaping the Quality Characteristics of an Olive Oil. Industrie Alimentari. 25: 549-555.
Morales M, Tsimidou M, In Harwood J, Aparicio R (eds) (2002). Handbook of Olive Oil. Gaitesburg: Aspen Publishers. pp: 393-438.
Mukherjee S, Lekli I, Gurusamy N, Bertelli AAA, Das DK (2009). Expression of the longevity proteins by both red and white wines and their cardioprotective components, resveratrol, tyrosol, and hydroxytyrosol. Free Radical Biology & Medicine. 46: 573–578.
Nenadis N, Tsimidou M (2002). Determination of Squalene in Olive Oil Using Fractional Crystallization for Sample Preparation. JAOCS. 79: 257-259.
Newcomb TG & Loeb LA (1998). Mechanism of mutagenicity of oxidatively-modified bases. In Molecular Biology of Free Radicals in Human Diseases, pp. 137–166 [OI Aruoma and B Halliwell, editors]. Saint Lucia: OICA International.
Ninni V (1999). A Statistical Approach to the Biosynthetic Route of the Fatty Acids in Olive Oil: Crosssectional and Time Series Analyses. J.Sci.Food Agric. 79: 2113-2121,
Ortega RM (2006). Importance of functional foods in the Mediterranean diet. Publ Health Nutr. 9: 1136–1140.
Owen R, Mier W, Giacosa A (2000). Identification of Lignans as Major Components in the Phenolic Fraction of Olive Oil. Clinic. Chem. 46: 976-988.
Owen RW, Giacosa A, Hull WE, Haubner R, Spiegelhalder B, Bartsch H (2000a). The antioxidant/anticancer potential of phenolic compounds isolated from olive oil. European Journal of Cancer. 36: 1235–1247.
Owen RW, Mier W, Giacosa A (2000). Identification of Lignans as Major Components in the Phenolic Fraction of Olive Oil. Clin Chem. 46: 976-988.
Palsamy P, Subramanian S (2009). Modulatory effects of resveratrol on attenuating the key enzymes activities of carbohydrate metabolism in streptozotocinnicotinamide induced diabetic. Chem. Biol. Interact. 179: 356–362.
Panza F, Solfrizzi V, Colacicco AM, D'introno A, Capurso C, Torres F, Del Parigi A, Capurso, S, Capurso A (2004). Mediterranean diet and cognitive decline. Public Health Nutr. 7: 959–963.
Papadopoulos G & Boskou D (1991). Antioxidant effect of natural phenols on olive oil. Journal of the American Oil Chemists Society. 68: 669–671.
Parthasarathy S (1991). Novel atherogenic oxidative modification of low density lipoprotein. Diabetes/Metabolism Reviews. 7: 163.
Perez-Jimenez F (2005). International conference on the healthy effect of virgin olive oil. Eur J Clin In vest. 35: 421–424.
Perez-Jimenez F, Castro P, Lopez-Miranda J (1999). Circulating levels of endothelial function are modulated by dietar y monounsaturated fat. Atherosclerosis. 145: 351–358.
Pérez-Jiménez F, Delgado Lista J, Pérez-Martínez P, López-Segura F, Fuentes F, Cortés B, Lozano A, López-Miranda J (2006). Olive oil and haemostasis: a review on its healthy effects. Public Health Nutrition. 9(8A): 1083–1088.
Perrin J (1992). Minor Components and Natural Antioxidants of Olives and Olive Oils. Rev. Franç.
Pezzuto JM (1997). Plant-derived anticancer agents. Biochemical Pharmacology. 53: 121–133.
Princen HMG, van Poppel G, Vogelazang C, Buytenhek R, Kok FJ (1992). Supplementation with vitamin E but not b-carotene in vivo protects low density lipoprotein from lipid peroxidation in vitro. Arteriosclerosis and Thrombosis. 12: 554.
Psaltopoulou T, Naska A, Ofranos P (2004). Olive oil, the Mediterranean diet, and ar terial blood pressure: the Greek Eu ropean Prospective Investigation into Cancer and Nutrition (EPIC) study. Am J Clin Nutr. 80: 1012–1018.
Psomiadou E, Karakostas K, Blekas G (2003). Proposed Parameters for Monitoring Quality of Virgin Olive Oil (Koroneiki cv). Eur. J. Lipid Sci. Technol. 105: 403-408.
Psomiadou E, Karakostas K, Blekas G (2003). Proposed Parameters for Monitoring Quality of Virgin Olive Oil (Koroneiki cv). Eur. J. Lipid Sci. Technol. 105: 403-408.
Psomiadou E, Tsimidou M (1998). Simultaneous HPLC Determination of Tocopherols, Carotenoids and Chlorophylls for Monitoring Their Effect on Virgin Olive Oil Oxidation. J. Agric. Food Chem. 46: 5132-5138.
Psomiadou E, Tsimidou M (2001). Pigments in Greek Virgin Olive Oils: Occurrence and Levels. J. Sci. Food Agric. 41: 640-647,
Rabascall NH, Riera JB (1987). Variations of the Tocopherols and Tocotrienols Content in the Obtention, Refining and Hydrogenation Processes of Edible Oils. Gracas Aceites. 38: 145-148.
Raederstorff D, Wang-schmidt Y, Wertz K (2010). Use of hydroxytyrosol as anti-aging agent. Pub. No. : US 2010/0130621 A1.
Rahmani M, Csallany A (1991). Chlorophyll and β-carotene Pigments in Moroccan Virgin Olive Oils Measured by High Performance Liquid Chromatography, JAOCS. 68: 672-674,
Rao C, Newmark H, Reddy B (1998). Chemopreventive Effect of Squalene on Colon Cancer. Carcinogenesis. 19: 287-290.
Reaven PD, Parthasarathy S, Grasse BJ, Miller E, Almazan F, Mattson FH, Khoo JC, Steinberg D, Witztum JL (1991). Feasibility of using an oleate-rich diet to reduce the susceptibility of low-density lipoprotein to oxidative modification in humans. American Journal of Clinical Nutrition. 54: 701–706.
Rice-Evans CA, Miller NJ, Paganga G (1996). Structureantioxidant activity relationship of flavonoids and phenolic acids. Free Radical Biology and Medicine. 20: 933–956.
Rohn TT, Hinds TR, Vincenzi FF (1993). Ion transport ATPases as targets for free radical damage. Protection by an aminosteroid of the Ca21 pump ATPase and Na1/K1 pump ATPase of human red blood cell membranes. Biochemical Pharmacology. 46: 525–534.
Rossell JB (2001). Frying: Improving quality. Woodhead Publishing Limited, CRC Press, Boca Raton. Boston. New York Washington, DC.
Ruiz-Canela M, Martínez-González MA (2011). Olive oil in the primary prevention of cardiovascular disease. Maturitas. 68: 245–250.
Ruiz-Gutierrez V, Juan ME, Cert A, Planas JM (2000). Determination of hydroxytyrosol in plasma by HPLC. Analytical Chemistry. 72: 4458–4461.
Ryan D, Robardo K (1998). Critical review: phenolic compounds in olives. Analyst. 123: 31-44.
Sacchi R (2007). Extraction technology In L'Extravergine, a guide to the best certified quality olive oil in the world. Oreggia, M. Ed Cucina Vini. 82-103.
Sadrzadeh SMH, Graf E, Panter SS, Hallaway PE, Eaton JW (1984). Hemoglobin. A biologic Fenton reagent. Journal of Biological Chemistry. 259: 14354–14356.
Salami M, Galli C, De Angelis L, Visioli F (1995). Formation of F2-isoprostanes in oxidized low density lipoprotein. Inhibitory effects of hydroxytyrosol. Pharmacological Research. 31: 275–279.
Scaccini C, Nardini M, D'Acquino M, Gentili V, Di Felice M, Tomassi G (1992). Effect of dietary oils on lipid peroxidation and on antioxidant parameters of rat plasma and lipoprotein fractions. Journal of Lipid Research. 33: 627–633.
Scania P, Casu M, Lai A (1999). Recognition and Quantitation of Cis-vaccenic and Eicosenoic Fatty Acids in Olive Oils by C-13 Nuclear Magnetic Resonance Spectroscopy. Lipids. 34: 757759.
Servilism M, Piacquadio P, De Stefano G (2002). Influence of a New Crushing Technique on the Composition of the Volatile Compounds and Related Sensory Quality of Virgin Olive Oil. Eur. J. Lipid Sci. Technol. 104: 483-489.
Shahidi F (1997). Natural antioxidants: Chemistry, health effects and applications. AOCS Press, Champaign, IL (USA), 97–149.
Singleton V, Orthofer R, Lamuela-Raventos R, In. Packer L (ed) (1999). Methods in Enzymology (Vol. 299). San Diego: Academic Press, 152-178.
Smith T, Yang G, Seril D (1998). Inhibition of 4-(methylnitrosamino)-1-(3-pyridyl)-1-butanone-induced Lung Tumorigenesis by Dietary Olive Oil and Squalene. Carcinogenesis. 19: 703-706.
Solfrizzi V, Colacicco AM, D'Introno A, Capurso C, Torres F, Rizzo C, Capurso A, Panza F, (2006). Dietary intake of unsaturated fatty acids and age-related cognitive decline: a 8.5-year follow up of the Italian longitudinal study on aging. Neurobiol. Aging. 27: 1694–1704.
Solfrizzi V, D'introno A, Colacicco AM, Capurso C, Del Parigi A, Capurso S, Gadaleta A, Capurso A, Panza F, (2005). Dietary fatty acids intake: possible role in cognitive decline and dementia. Exp. Gerontol. 40: 257–270.
Solfrizzi V, Panza F, Capurso A (2003). The role of diet in cognitive decline. J. Neural. Transm. 110: 95–110.
Solfrizzi V, Panza F, Torres F, Mastroianni F, Del Parigi A, Venezia A, Capurso A, (1999). High monounsaturated fatty acids intake protects against age-related cognitive decline. Neurology. 52: 1563–1569.
Speroni E, Guerra MC, Minghetti A, Crespi-Perellino N, Pasini P, Piazza F, Roda A (1998). Oleuropein evaluated in vitro and in vivo as an antioxidant. Phytotherapy Research. 12: 98–100.
Sumpio B, Cordova A, Be rke-Schlessel D (2006). Green tea, the "Asian paradox," and cardiovascular disease. J Am Coll Surg. 202:813–825.
Sung B, Jin Jung K, Seok Song H, Jin Son M, Pal Yu B, Young Chung H (2005). cDNA representational difference analysis used in the identification of genes related to the aging process in rat kidney. Mechanisms of Ageing and Development. 126: 882–891.
Tanaka T, Makita H, Kawamori T, Kawabata K, Mori H, Murakami A, Satoh K, Hara A, Ohigashi H, Koshimizu K (1997). A xanthine oxidase inhibitor 10 acetoxychavicol acetate inhibits azoxymethane-induced colonic aberrant crypt foci in rats. Carcinogenesis. 18: 1113–1118.
Tiscornia E, Fiorina N, Evangelisti F (1982). Chemical Composition of Olive Oil and Variations Induced by Refining. Riv. Ital. Sost. Grasse. 59: 519-555.
Trichopoulou A, Costacou T, Bamia C (2003). Adherence to a Mediterranean Diet and Survival in a Greek Population. N Engl J Med. 348: 2599-2608.
Trichopoulou A, Orfanos P, Norat T (2005). Modified Mediterranean Diet and Survival: EPIC- elderly Prospective Cohort Study. Bmj. 330: 991.
Tuck KL, Freeman MP, Hayball PJ, Stretch GL, Stupans I (2001). The in vivo fate of hydroxytyrosol and tyrosol, antioxidant phenolic constituents of olive oil, after intravenous and oral dosing of labeled compounds to rats. Journal of Nutrition. 131: 1993–1996.
Tuck KL, Hayball PJ (2002). Major phenolic compounds in olive oil: Metabolism and health effects. The Journal of Nutritional Biochemistry. 13: 644.
Tuck KL, Hayball PJ, Stupans I (2002). Structural characterization of the metabolites of hydroxytyrosol, the principal phenolic component in olive oil, in rats. Journal of Agricultural and Food Chemistry. 50: 2404–2409.
Uccella N (2001). The olive biophenols: hedonic-sensory descriptors of evoo and wotos in the Mediterranean aliment culture. In Food flavours and Chemistry: Advances of the New Millennium. A. H. Spanier, F. Shahidi, T.H. Parliment, C. J. Mussinan, C. T. Ho, E. TratrasContis Eds. The Royal Society of Chemistry Publishers, Cambridge, UK. 253-265.
van Dyke BR, Saltman P (1996). Hemoglobin: a mechanism for the generation of hydroxyl radicals. Free Radical Biology and Medicine. 20: 985–989.
Visioli F, Bellomo G, Montedoro G, Galli C (1995). Low density lipoprotein oxidation is inhibited in vitro by olive oil constituents. Atherosclerosis. 117:25–32.
Visioli F, Bellomo G, Montedoro GF, Galli C (1995a). Low density lipoprotein oxidation is inhibited in vitro by olive oil constituents. Atherosclerosis. 117: 25–32.
Visioli F, Caruso D, Plasmati E, Patelli R, Mulinacci N, Romani A, Galli G, Galli C (2001). Hydroxytyrosol, as a component of olive mill waste water, is dose-dependently absorbed and increases the antioxidant capacity of rat plasma. Free Radical Research. 34: 301– 305.
Visioli F, Galli C (1998). The effect of minor constituents of olive oil on cardiovascular disease: ne w findings. Nutr Rev. 56: 142– 147.
Visioli F, Galli C (1998b). The effect of minor constituents of olive oil on cardiovascular disease: new findings. Nutrition Reviews. 56: 142–147.
Visioli F, Galli C (2001). Antiatherogenic components of olive/olive oil. Current Atherosclerosis Reports. 3: 64–67.
Visioli F, Galli C (2003). Olives and their production waste products as sources of bioactive compounds. Current Topics in Nutraceutical Research. 1: 85–88.
Visioli F, Galli C (2003). Olives and their production waste products as sources of bioactive compounds. Current Topics in Nutraceutical Research. 1: 85–88.
Visioli F, Galli C, Bornet F, Mattei A, Patelli R, Galli G, Caruso D (2000). Olive oil phenolics are dose-dependently absorbed in humans. FEBS Letters. 468: 159–160.
Vissers MN, Zock PL, Roodenburg AJC, Leenen R, Katan MB (2001). Olive oil phenols are absorbed in humans. American Society for Nutritional Sciences. 409–417.
Wiseman SA, Mathot JNNJ, De Fouw NJ, Tijburg LBM (1996). Dietary non-tocopherol antioxidants present in extra virgin olive oil increase the resistance of low density lipoproteins to oxidation in rabbits. Atherosclerosis. 120: 15–23.
Witztum JL, Steinberg D (2001). The Oxidative Modification Hypothesis of Atherosclerosis: Does it Hold for Humans? Trends Cardiovasc Med. 11: 93-102,
Yermilov V, Rubio J, Ohshima H (1995). Formation of 8-nitroguanine in DNA treated with peroxynitrite in vitro and its rapid removal from DNA by depurination. FEBS Letters. 376: 207–210.
Zhu L, Liu Z, Feng Z, Hao J, Shen W, Li X, Sun L, Sharman E, Wang Y, Wertz K, Weber P, Shi X, Liu J (2010). Hydroxytyrosol protects against oxidative damage by simultaneous activation of mitochondrial biogenesis and phase II detoxifying enzyme systems in retinal pigment epithelial cells. Journal of Nutritional Biochemistry. 21: 1089–1098.





 OLEA di G. Quaia │ P.I. 00135660935 │
OLEA di G. Quaia │ P.I. 00135660935 │